Метаданни
Данни
- Включено в книгата
- Оригинално заглавие
- DNA: The Secret of Life, 2003 (Пълни авторски права)
- Превод отанглийски
- Красимира Матева, 2004 (Пълни авторски права)
- Форма
- Научен текст
- Жанр
- Характеристика
-
- Няма
- Оценка
- 5,6 (× 12гласа)
- Вашата оценка:
Информация
Издание:
Джеймс Д. Уотсън, Андрю Бери. ДНК — Тайната на живота
Редактор: Таня Боянова
Коректор: Ангелина Вълчева
Дизайн на корицата: Бисер Тодоров
Предпечат: Таня Петрова, Бисер Тодоров
ИК „ИнфоДАР“ ЕООД, 2004 г.
ISBN: 954-761-148-8
История
- —Добавяне
Пета глава
ДНК, долари и лекарства: Биотехнология
 Списание „Тайм“ бележи раждането на биотехнологичния бизнес (и очаква с нетърпение кралска венчавка).
Списание „Тайм“ бележи раждането на биотехнологичния бизнес (и очаква с нетърпение кралска венчавка).
Хърб Бойър има свое разбиране за срещите. Вече видяхме как разговорът му със Стенли Коен в една закусвалня в Уайкики през 1972 година доведе до експеримента, превърнал рекомбинантната ДНК в реалност. През 1976 година светкавицата блесна за втори път: сцената беше Сан Франциско, срещата — с капиталиста предприемач Боб Суонсън, а резултатът — цяла нова индустрия, която щеше да получи името „биотехнология“.
Едва двайсет и седемгодишен, когато поема инициативата и се свързва с Бойър, Суонсън вече си е извоювал име на човек, финансиращ особено рискови начинания. Той търси нови бизнес възможности и тъй като има опит в науката, усеща перспективите на новосъздадената технология на рекомбинантната ДНК. Проблемът е, че всеки, с когото разговаря, му казва едно и също: че прибързва. Дори Стенли Коен е на мнение, че от комерсиалното й приложение ги делят няколко години. Бойър пък не обича нещата, които го отклоняват от работата му, особено когато имат нещо общо с костюмираните мъже, които винаги изглеждат не на място в света на академичната наука, където всички ходят с дънки и тениски. Суонсън обаче успява някак си да го придума да му отдели десет минути от своето време през един петъчен следобед.
Десетте минути се превръщат в няколко часа, а после — в няколко бири, когато срещата се прехвърля в близкия бар, където Суонсън открива, че е пробудил един пребиваващ в латентно състояние предприемач. Бойър обявява за първи път амбицията си „да стане успяващ бизнесмен“ в годишника на гимназията в Дери Бъро за 1954 година.
Основното предложение е изключително просто: да се открие начин за използване на технологията Коен-Бойър за производството на годни за разпространение на пазара протеини. Генът на „полезен“ белтък, например с терапевтична стойност като човешкия инсулин, би могъл да се вкара в бактерия, която на свой ред да започне да произвежда въпросния белтък. Тогава беше въпрос единствено на разрастване на производството в по-широк мащаб — от епруветките в лабораториите, в цистерни с индустриални размери, и да се събира произвежданият протеин. По принцип наистина е просто, но не е толкова лесно на практика. Въпреки всичко Бойър и Суонсън са изпълнени с ентусиазъм: всеки дава по 500 $, за да постави началото на съдружието, предназначено да експлоатира новата технология. През април 1976 година двамата създават първата биотехнологична компания в света. Предложението на Суонсън да я нарекат „Хър-Боб“, комбинация от първите имена на двамата, е отхвърлено безмилостно от Бойър, който предлага вместо това Genentech, съкращение от genetic engineering technology, технология на генното инженерство.
Инсулинът е първата очевидна комерсиална цел за Genentech. Диабетиците се нуждаят от редовното инжектиране на този протеин, защото телата им естествено го произвеждат или в много малки количества (диабет II тип), или изобщо не го произвеждат (диабет I тип). Преди откриването през 1921 година на ролята на инсулина за регулиране нивото на кръвната захар, диабет I тип е смъртоносен. Оттогава производството на инсулин, който да се използва от диабетиците, се превръща в солиден клон на индустрията. Тъй като нивото на кръвната захар се управлява почти по един и същ начин при всички бозайници, възможно е да се използва инсулин от домашни животни, предимно свине и крави. Техният инсулин се различава малко от човешкия: свинският инсулин е с една аминокиселина в петдесет и първата аминокиселинна протеинова верига, а кравешкият — с три. Тези различия понякога могат да причинят нежелателен ефект в пациентите; диабетиците в някои случаи развиват алергия към „чуждия“ белтък. Целта на биотехнологията е да подсигури диабетиците с истинския продукт — човешки инсулин.
Тъй като диабетиците само в САЩ са осем милиона, производството на инсулин обещава да се превърне в биотехнологична златна мина. Бойър и Суонсън обаче не са единствените, даващи си сметка за неговия потенциал. Група колеги на Бойър в Калифорнийския университет в Сан Франциско, както и Уоли Гилбърт в Харвард също са наясно, че клонирането на човешки инсулин би било много ценно както от научна, така и от търговска гледна точка. През май 1978 година залогът се увеличава, тъй като Гилбърт и още неколцина от Съединените щати и Европа създават своя компания, Biogen. Контрастът в произхода на Biogen и Genentech показва колко бързо се развиват нещата: Genentech е замислена от двайсет и седемгодишен мъж, готов да прозвъни толкова телефони, колкото е необходимо, за да открие нужния човек; Biogen е създаден от консорциум от опитни предприемачи, привлекли едни от най-добрите учени в тази област. Genentech се роди в един бар в Сан Франциско, Biogen — в луксозен европейски хотел. И двете компании обаче, имат една и съща визия и инсулинът е важна част от нея. Надбягването започва.
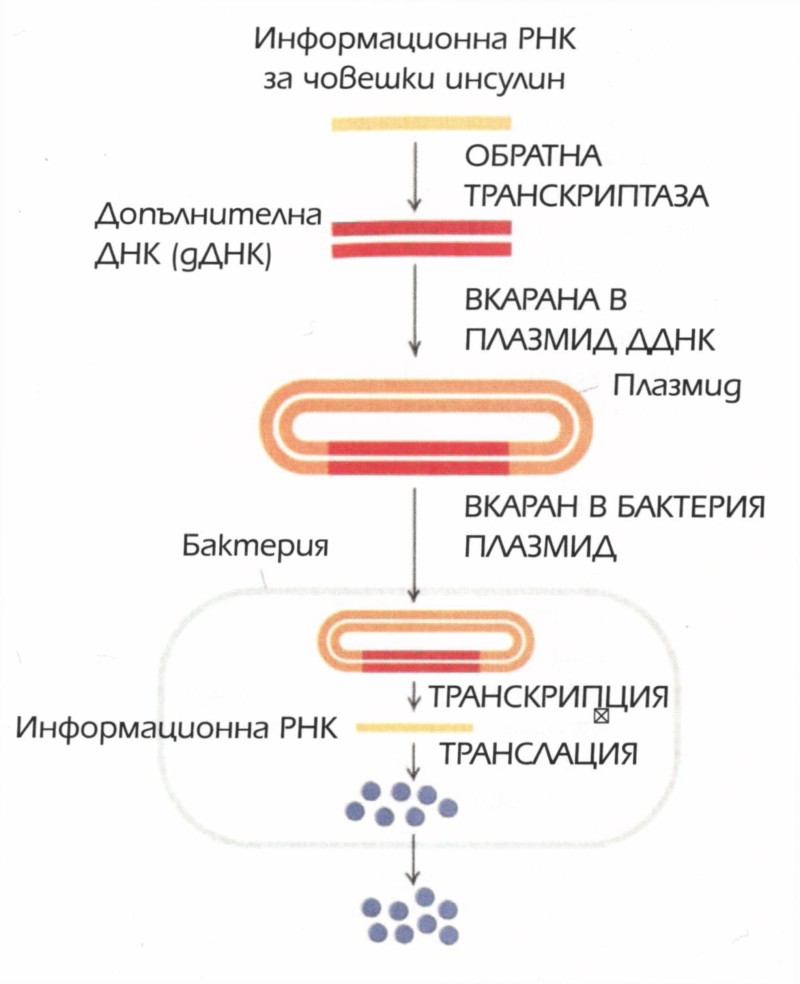
Не е лесно да накараш една бактерия да произвежда човешки протеин. Особено в присъствието на интрони, некодиращите сегменти на ДНК, открити в човешките гени. Тъй като нямат интрони, бактериите не са в състояние да боравят с тях. Докато човешката клетка „редактира“ грижливо информационната ДНК, за да отдели тези некодиращи сегменти, бактерията, лишена от подобни способности, не може да произведе белтък от човешки ген. И така, преди E.coli да бъдат впрегнати да произвеждат човешки протеини от човешки гени, трябва да бъде преодоляна интронната пречка.
Съперниците в бизнеса подхождат към проблема по различни начини. Стратегията на Genentech е да се синтезират химически без-интронови порции на гена, които после да се вкарат в плазмид. Това всъщност е клониране на изкуствено копие от оригинален ген. Днес този тромав метод се използва рядко, но за въпросния период стратегията на Genentech е наистина умна. От срещата в Азиломар, посветена на опасността от биотехнологиите, не бе изминало много време, и на генетичното клониране, особено когато включваше човешки гени, все още се гледаше с огромно подозрение, и бе обект на строги ограничения. Genentech обаче намира изход от ситуацията, като използва изкуствено копие на гена, а не извлечен от човешко същество. Търсенето на начин за производство на инсулин от компанията може да продължи безпрепятствено.
Конкурентите на Genentech предпочитат алтернативен подход, който се използва и до днес; но тъй като работят с извлечен от действителни човешки клетки ДНК, те скоро се озовават в истински кошмар от правни правила и ограничения. Техният метод използва едно от най-изненадващите и до днес открития в молекулярната биология: че централната догма, управляваща потока на генетична информация — правилото, че ДНК произвежда РНК, която на свой ред произвежда белтъците — от време на време може да се нарушава. През петдесетте години на XX век учените откриват група вируси, съдържащи РНК, но без ДНК. Член на тази група е и HIV, вирусът, причиняващ СПИН. По-нататъшните изследвания показват, че тези вируси могат да превръщат своята РНК в ДНК, след като я вкарат в клетката-приемник. Следователно тези вируси противоречат на централната догма с обратната си пътека РНК → ДНК. Това се осъществява от един ензим, наречен „обратна транскриптаза“; той именно превръща РНК в ДНК. Откритието, направено през 1970 година, спечелва на Хауърд Темин и Дейвид Балтимор Нобеловата награда за физиология или медицина за 1975 година.
Обратната транскриптаза предлага на Biogen и на други елегантен начин да създадат свой ген на човешки инсулин без интрони, който да бъде вкаран в бактерията. Първата стъпка е да се изолира информационната РНК, произведена от инсулиновия ген. Благодарение на процеса на редактиране, информационната РНК е освободена от интроните на ДНК, от която е копирана. Самата РНК не е особено използваема, защото, за разлика от ДНК, е деликатна молекула, податлива на бързо деградиране. Освен това системата Коен-Бойър предлага в бактериалните клетки да се вкарва ДНК, а не РНК. Целта е от редактираната молекула информационна РНК да се направи ДНК, като се използва обратна транскриптаза. Резултатът би бил парче от ДНК без интроните, но с цялата информация, необходима за бактерията, за да произведе човешки инсулин — пречистен инсулинов ген.
В крайна сметка Genentech спечелва надбягването, но на косъм. Като използва метода на обратната транскриптаза, екипът на Гилбърт успява да клонира ген от плъх за инсулин и след това да убеди една бактерия да произведе протеина на плъха. Остава само процесът да се повтори с човешки ген. Тук обаче Biogen се натъква на своето законово Ватерло. За да клонира човешка ДНК, екипът на Гилбърт трябва да намери специалното съоръжение Затвор P4, тоест типа с най-високо ниво на изолираност, изискван за работа с такива неприятни същества като вируса Ebola. Те успяват да убедят английската армия да им осигури достъп до Портън Даун, военна биологична лаборатория в Южна Англия.
В книгата си за надбягването при клонирането на инсулина, Стивън Хол разказва за почти сюрреалистичните унижения, на които са подложени Гилбърт и неговите колеги.
Дори влизането в лабораторията тип Затвор P4 бе изпитание. След като свалеше всичките си дрехи, всеки един от изследователите обуваше доставени от правителството бели боксерки, черни гумени ботуши, сини дрехи, наподобяващи пижама, кафява престилка като тези, които носеха лекарите в болниците, отворена отзад, два чифта ръкавици и синя найлонова шапка, подобна на тези за баня. След това всичко се измиваше бързо с формалдехид. Всичко. Цялото оборудване, всички шишенца, всички стъкленици, цялото оборудване. Всичко, написано от учените върху хартия, също трябваше да се измие по този начин; затова изследователите не изпълняваха докрай всички инструкции и поставяха някои от листовете в найлонови пликчета с надеждата формалдехидът да не проникне през тях и да превърне хартията в кафява, набръчкана, безформена маса, наподобяваща пергамент. Всеки документ, изложен на въздуха в лабораторията, в крайна сметка трябваше да бъде унищожен, така че харвардската група нямаше възможност дори да прави записки. След като преминеха през ваната с формалдехида, учените слизаха няколкото стъпала, които ги водеха до самата лаборатория тип Затвор P4. Същата хигиенична безсмислица, този път със задължително вземане на душ, трябваше да се повтори всеки път, когато някой излезе от лабораторията.
Всичко това трябваше да бъде изтърпяно заради семплата привилегия да се клонира част от човешка ДНК. В днешните не толкова параноични и по-добре осведомени времена същата процедура често се извършва в елементарни лаборатории от студентите, които тепърва се запознават с молекулярната биология. Гилбърт и неговият екип така и не успяват да клонират инсулиновия ген. И нищо чудно, че обвиняват за това изживяния кошмар Затвор P4.
Екипът на Genentech не е подложен на подобни законови изпитания, но техническите предизвикателства, с които е свързано вкарването на синтезиран ген в E.coli, за да произведе инсулин от него, са приблизително същите. За бизнесмена Суонсън проблемът не е просто научен. От 1923 година пазарът на инсулин в САЩ се доминира от един производител, Eli Lilly. Към края на седемдесетте години на XX век това е компания за три милиарда долара, държаща 85% от пазара на инсулин. Суонсън е наясно, че Genentech не е в състояние да се конкурира с огромната „горила“, дори предлагайки произведен чрез генно инженерство човешки инсулин, превъзхождащ животинския вариант на Lilly. Той решава да се договори и предлага на Lilly ексклузивен лиценз за инсулина на Genentech. И докато съдружниците му превиват гръб в лабораторията, Суонсън отива да преговаря, убеден, че Lilly ще се съгласи на предложението му. Дори гигант като тази компания не може да си позволи да не се възползва от възможностите, които предлага рекомбинантната ДНК, а именно бъдещето на фармацевтичната продукция.
Но Суонсън не е единственият, дошъл с предложение, и Lilly всъщност вече финансира част от усилията на конкуренцията. Официален пратеник на Lilly е изпратен в Страсбург, Франция, за да се запознае с обещаващ опит, подобен на Гилбъртовия, за клониране на инсулиновия ген. Но когато се разчува, че Genentech пръв се е справил с тази задача, вниманието на Lilly незабавно се обръща към Калифорния. Genentech и Lilly подписват споразумение на 25 август 1978 година, един ден след окончателното експериментално потвърждение. Акциите на Genentech се пускат на борсата през септември 1980 година. За минути цената на им се качва от началната стойност 35 $ до 89 $. Това е най-бързото покачване на стойност на акции в историята на Уолстрийт до този момент. Бойър и Суонсън внезапно се оказват притежатели на по шейсет и шест милиона долара.
По традиция единственото, което има значение в академичната биология, е кой е открил пръв дадения факт. И възнаграждението е слава, а не пари. Има и изключения — Нобеловата награда например, се придружава от солидно финансово възнаграждение, но по принцип се занимавахме с биология, защото я обичахме. Скромните ни академични заплати определено не бяха особен стимул.
Със зараждането на биотехнологиите това положение се промени. Осемдесетте години на XX век станаха свидетели на такива взаимоотношения наука-търговия, които бяха немислими само едно десетилетие по-рано. Сега биологията се превърна в една от игрите, носещи големи пари, а с тях възникна и съвсем нов начин на мислене и нови усложнения.
Първо, основателите на компаниите за биотехнологии бяха предимно университетски преподаватели, затова не е изненадващо, че изследванията, които трябваше да се превърнат в основата на комерсиалните перспективи на компаниите, най-често се извършваха в техните университетски лаборатории. Например Чарлз Вайсман, един от основателите на Biogen, клонира в Цюрихската си университетска лаборатория човешки интерферон, който, като лекарство за множествена склероза, оттогава носи най-големите приходи на компанията. А Харвардският университет е домакин на, в крайна сметка, останалите безуспешни опити на Уоли Гилбърт да прибави рекомбинантния инсулин към продуктите на Biogen. Назряваха въпроси като: „Редно ли е да се позволява на професорите да забогатяват на базата на работата, извършена с университетското им оборудване? Дали комерсиализацията на академичната наука няма да породи непримирими конфликти в интересите?“ А проспектът за настъпването на новата ера на широкомащабната молекулярна биология, разпали все още ненапълно угасналите въглени от дебатите за безопасност; сега, когато залогът бяха наистина големите пари, докъде можеха да стигнат капитаните на новата индустрия в опитите си, поемайки все по-голям риск?
Първата реакция на Харвард бе създаването на собствена биотехнологична компания. При наличието на предостатъчно предприемачески капитал и интелектуалния капитал на две от университетските звезди в молекулярната биология, Марк Пташне и Том Мейниатис, бизнес планът изглеждаше подсигурен; в играта на биотехнологии очевидно се включваше голям играч. През есента на 1980 година обаче, планът се разпадна. Когато се стигна до гласуване, факултетът отказа да позволи на Харвард да потопи белите си като цветове на лилия пръсти в калните комерсиални води. Съществуваха притеснения, че начинанието ще породи конфликт на интересите вътре във факултета по биология: ами ако престанеха да наемат хората си единствено според академичните им заслуги и започнеха да се съобразяват най-вече с потенциала им да допринесат с нещо за фирмата? В крайна сметка Харвард бе принуден да се оттегли и да се откаже от двайсетте си процента от общото вложение в компанията. Шестнайсет години по-късно стана ясно колко бе изгубил, когато фирмата бе продадена на фармацевтичния гигант Wyeth за 1 250 000 000 $. И до днес факултетът по молекулярна и клетъчна биология в Харвард няма установен фонд за поддържане на изследванията извън осигуряването на заплатите.
Решението на Пташне и Мейниатис да продължат въпреки това, породи нови препятствия. Мораториумът на кмета Велучи за изследванията на рекомбинантната ДНК бе останал в миналото, но настройката срещу ДНК оставаше. Грижливо избягвайки недвусмислено биотехнологично название като Biogen и Genentech, Пташне и Мейниатис наричат своята компания „Институт по генетика“, с надеждата да предизвикат аналогия с не толкова заплашителната ера на плодовата мушица в биологията, отколкото със смелия нов свят на ДНК. Поради същата причина новородената компания решава да се установи не в Кеймбридж, а в съседния град Съмървил. Бурният процес в кметството на Съмървил обаче демонстрира, че ефектът от делото на Велучи съвсем не се ограничава само с град Кеймбридж: отказват да дадат на „Института по генетика“ лиценз за работа. За щастие град Бостън, който се намира срещу Кеймбридж, от другата страна на Чарлз ривър, се оказва по-гостоприемен и новата фирма се установява в празна болнична сграда в бостънския квартал „Мишън Хил“. Тъй като постепенно ставаше все по-ясно, че рекомбинантните методи не представляват опасност за здравето или околната среда, антибиотехнологичният фанатизъм от рода на проявения от Велучи не можеше да издържи още дълго. След няколко години „Институтът по генетика“ се премества в Северен Кеймбридж, срещу своя родител, университета, който го бе изоставил непосредствено след неговото раждане.
През изминалите двайсет години подозрителността и прекалената святост, съпровождаща ранните дни от свързването на академичната и комерсиалната молекулярна биология, отстъпи място на нещо подобно на продуктивна симбиоза. Сега вече университетите насърчават активно своите преподаватели да култивират комерсиални интереси. Поучени от грешката на Харвард към „Института по генетика“, те започнаха да се възползват от изгодното приложение на изобретените на тяхната територия технологии. Целта на новите практически кодекси е да се избегне конфликтът на интереси за преподавателите, „яхнали“ и двата свята. В ранните дни на биотехнологиите, академичните учени често бяха обвинявани, че се продават, когато се свързваха с някоя компания. Сега възползването от комерсиалното приложение на биотехнологиите се превърна в стандартна част от успешната кариера в областта на ДНК. Парите вече са на една ръка разстояние, а не липсва и интелектуално възнаграждение, тъй като, поради основателни бизнес причини, биотехнологиите се намират неизменно сред първите редици на научния прогрес.
Стенли Коен доказа, че е един от първите не само в областта на технологиите, но и в еволюирането от чисто академично съзнание до върховете в свързаната с големите пари биология. Той е наясно от самото начало с потенциала за комерсиално приложение на рекомбинантната ДНК, но никога не му минава през ума, че методът за клониране Коен-Бойър би трябвало да се патентова. Тази идея дава Нилс Раймерс от кантората по технологично лицензиране в Станфорд, след като прочита на първа страница на „Ню Йорк Таймс“ за голямата победа на екипа. Първоначално Коен е изпълнен със съмнения; според него въпросният пробив би бил невъзможен без безплатно споделената информация за правените поколения наред изследвания и следователно не е редно да се патентова нещо, което е просто последният стадий от цялото това развитие. Но всяко изобретение се гради върху предишните (парният локомотив е можел да бъде открит само след изнамирането на парната машина); и патентите принадлежат по право на новаторите, разширили изобретенията от миналото по решителен и влиятелен начин. През 1980 година, шест години след първото подаване на молбата от Станфорд, процесът Коен-Бойър получава патент.
По принцип патентоването на методи може да задуши новаторството, като ограничи използването на важни технологии, но Станфорд се справи мъдро с въпроса и не се стигна до подобни отрицателни последствия. Коен и Бойър (и техните институции) бяха възнаградени за значимия им в комерсиално отношение принос, но не за сметка на научния прогрес. Първо, патентът осигуряваше използването на технологията да се заплаща само от корпоративните единици; академичните изследователи можеха да я използват безплатно. Второ, Станфорд не се поддаде на изкушението да наложи прекалено висока такса за лиценза, което щеше да остави използването на рекомбинантната ДНК само в ръцете на най-богатите компании. За относително скромната сума от 10 000 $ годишно и максимум 3% от продажбата на продукти, получени посредством технологията, методът Коен-Бойър бе на разположение за всеки, който би искал да го използва. Тази стратегия, добра за науката, се оказа също така добра и за бизнеса: патентът осигури около двеста и петдесет милиона долара за Калифорнийския университет в Сан Франциско и Станфорд. И Бойър, и Коен великодушно дариха част от своя дял от печалбата на своите университети.
Беше въпрос единствено на време преди генетично променените от технологията организми също да бъдат патентовани. Първият случай от този род бе всъщност още през 1972 година и бе свързан с бактерия, модифицирана чрез традиционни генетични методи, а не чрез технологията на рекомбинантната ДНК. Посланието за биотехнологичния бизнес бе повече от ясно: след като модифицираната с конвенционални техники бактерия можеше да се патентова, значи щяха да се патентоват и модифицираните чрез новите рекомбинантни методи бактерии.
През 1972 година Ананда Чакрабарти, учен-изследовател в „Дженерал Електрик“, кандидатства за патент върху щам на бактерията Pseudomonas, който е разработил за разграждането на нефтени петна. Дотогава най-ефикасният начин за разлагане на разлетия нефт е използването на различни бактерии, всяка от които разгражда различен компонент от нефта. Като комбинира различни плазмиди, всеки кодиращ различна пътека за разграждане, той успява да произведе супер разграждащ щам на Pseudomonas. Първата молба за получаване на патент на Чакрабарти е отхвърлена, но след като осем години си проправя път през правната система, най-после, през 1980 година, получава одобрение и Върховният съд гласува с пет срещу четири гласа в негова полза, заключавайки, че „живият, създаден от човека микроорганизъм подлежи на патентоване“, ако, както във въпросния случай, „е резултат от човешката изобретателност и изследвания“.
Въпреки изясняването, постигнато чрез случая на Чакрабарти, първите съприкосновения на биотехнологията със закона са неизбежно объркани. Залогът е висок, както ще се убедим в Десета глава от случая с вземането на отпечатъци от пръстите, а юристи, съдебни заседатели и учени често говорят на различни езици. През 1983 година и Genentech, и „Институтът по генетика“ клонират успешно гена за тъканния плазминогенен активатор (т-ПА), важно оръжие срещу кръвните съсиреци, които предизвикват инсулт и инфаркт. „Институтът по генетика“ обаче не кандидатства за патент, смятайки, че научната основа при клонирането на т-ПА е „очевидна“, с други думи, неподлежаща на патентоване. Genentech обаче кандидатства и го получава и следователно, като използва въпросната технология, „Институтът по генетика“ нарушава закона.
Делото се разглежда първо пред английския съд. Съдията, мистър Джъстис Уитфорд, седи зад голям куп книги през по-голямата част от съдебния процес, с вид на спящ. Основният въпрос е дали първите, които клонират даден ген, трябва да получат всички права върху по-нататъшното производство и употреба на белтъка. В съдебното заключение за „Института по генетика“ и неговия поддръжник, фармацевтичната компания „Уелкъм“, Джъстис Уитфорд посочва, че Genentech може да обоснове претенции само за ограничения процес, използван от тях при клонирането на т-ПА, но не и широките претенции за самия протеинов продукт. Genentech обжалва решението на съда. При обжалване на подобни специализирани случаи в Англия участват трима съдии специалисти, консултирани от независим експерт в областта, за даденото дело — Сидни Бренър. Съдиите отхвърлят жалбата на Genentech, съгласни с „Института по генетика“, че „откритието“ наистина е очевидно и следователно патентът на Genentech е невалиден.
В Съединените щати подобни случаи се оспорват пред съдебни заседатели. Адвокатите на Genentech правят всичко възможно, нито един от членовете на журито да няма висше образование. Така онова, което може би щеше да бъде очевидно за учения или правните експерти, получили научно образование, не беше очевидно за въпросните съдебни заседатели. Те гласуваха срещу „Института по генетика“ и обявиха за валиден базиращия се на пълните претенции патент на Genentech. Резултатът може би не беше сред най-справедливите в американското правосъдие, но делото все пак създаде прецедент: оттогава нататък хората кандидатстваха за патент, дори научната му закваска да беше „очевидна“. В бъдещите диспути единственото, което имаше значение, бе кой е клонирал пръв гена.
Аз смятам, че добрите патенти създават баланс: те признават и възнаграждават новаторската работа и я предпазват от ограбване, а освен това дават възможност на новата технология да се изяви максимално. За жалост мъдрият пример на Станфорд не се следва при всеки случай на важна нова ДНК методология. Полимеразната верижна реакция (ПВР) е безценна техника за умножаване на малки количества ДНК. Изобретена през 1983 година в Cetus Corporation, ПВР, за която ще научим повече в Седма глава във връзка с Проекта за изучаване на човешкия геном, бързо се превърна в една от движещите сили в академичната молекулярна биология. Комерсиалното й приложение обаче беше далеч по-ограничено. След като даде комерсиален лиценз на „Кодак“, Cetus продаде ПВР за триста милиона долара на швейцарския гигант „Хофман-Ларош“, производител на химически, фармацевтични и медицинско-диагностични продукти. На свой ред „Хофман-Ларош“ реши, вместо да продължава да дава лицензи, да увеличи максимално възвръщаемостта от своята инвестиция, като установи монопол върху диагностичното тестване на основата на ПВР. Като част от тази стратегия, тя завладя бизнеса, свързан с изследването за СПИН. И едва когато наближи датата на изтичане срока на патента, фирмата даде лицензи за технологията, предимно на други големи диагностични компании, които можеха да си позволят пропорционално високите такси. За да осигури допълнителни приходи от същия патент, „Хофман-Ларош“ се възползва също така от лоста за налагане на стабилни финансови изисквания към производителите на машини за осъществяване на ПВР. И така, за да пусне на пазара просто съоръжение за използване от ученици, Центърът „Долън“ за изучаване на ДНК към лабораторията в Колд Спринг Харбър, трябваше да плаща на компанията 15% от приходите.
Дори още по-гибелен ефект върху възможността да се използва продуктивността на новите технологии оказаха юристите, заели се агресивно да патентоват не само новите изобретения, но и общите идеи, върху които почиват. Патентът върху генетично променената мишка на Фил Ледър е чудесна илюстрация на казаното. При изследванията върху рака, групата на Ледър в Харвард създава порода мишки, особено податлива към рака на гърдата. Постигат го, като използват утвърдени техники за вкарване на генетично получен миши раков ген в оплодена яйцеклетка. Тъй като причиняващият рак при мишките фактор може би е подобен на този, който действа при хората, очаква се тази „онко-мишка“ да ни помогне да проумеем рака при хората. Но вместо да кандидатстват за патент, ограничен до конкретната мишка, създадена от екипа на Ледър, Харвардските адвокати търсят възможност за патент, покриващ всички податливи на рак трансгенни животни, дори не само мишките като цяло. Този всеобхватен патент е получен през 1988 година и така се ражда страдащият от рак малък гризач, получил прякора „Харвардска мишка“. Всъщност, тъй като работата в лабораторията на Ледър се финансира от „Дю Пон“, търговските права остават не в университета, а в химическия гигант. По-правилно би било „Харвардската мишка“ да се нарече „мишката на «Дю Пон»«. Независимо какво е името й, обаче, патентът повлия дълбоко върху изследванията на рака и намали значително продуктивността им.
Компаниите, заинтересовани от създаването на нови породи онко-мишки, и тези, които искаха да използват съществуващите породи ракови мишки за тестване на експериментални лекарства, се отказваха заради високите такси, изисквани от „Дю Пон“. „Дю Пон“ започна да настоява академичните институции да разкриват осъществените от тях експерименти чрез използването на патентованата от компанията онко-мишка. Това е пример за безпрецедентно и неприемливо нахлуване на големия бизнес в научните лаборатории. Калифорнийският университет в Сан Франциско, Институтът „Уайтхед“ към Масачузетския технологичен институт, Лабораторията на Колд Спринг Харбър и други изследователски институции отказаха сътрудничеството си.
Когато патентите включват технологии, благодарение на които е възможно осъществяването на необходимите молекулярни манипулации, притежателите на патента са в състояние буквално да прекратят цяла област на изследвания, за да получат подкуп. При кандидатстването за получаване на патент, това трябва да се прави единствено по собствените му заслуги, като се съблюдават някои основни правила. Патентите върху очевидно жизненонеобходимите за научния прогрес методи трябва да следват примера, поставен от случая Коен-Бойър: технологията трябва да бъде общодостъпна (а не контролирана от един-единствен притежател на патента) и с разумна цена. Тези ограничения в никакъв случай не са срещу етиката на свободното предприемачество. Ако е наистина стъпка напред, новият метод ще се използва масово и дори скромната такса ще носи значителни приходи. Патентите върху продукти обаче — лекарства, трансгенни организми — би трябвало да се ограничават до конкретния създаден продукт, а не върху цяла поредица от допълнителни продукти, за които може да се сети човек покрай вече съществуващия.
Триумфът на инсулина на Genentech привлича всеобщото внимание върху биотехнологиите. Четвърт век по-късно генното инженерство с технологията на рекомбинантната ДНК вече е рутинна част от фармацевтичната индустрия. Тези процедури позволяват да се произвеждат в големи количества човешки протеини, които се добиват трудно по друг начин. В много случаи получените чрез генно инженерство продукти са много по-безопасни за терапевтична и диагностична употреба от своите предшественици. Изключително ниският ръст, нанизъм, често е резултат от липсата на човешкия хормон на растежа (ЧХР). През 1959 година лекарите започват да лекуват нанизма с ЧХР, който тогава се добива единствено от мозъците на трупове. Лечението дава чудесни резултати, но по-късно се изяснява, че носи риск от ужасна инфекция: понякога пациентите развивали болестта на Кройцфелд-Якоб — ужасно, увреждащо главния мозък заболяване, подобно на тъй наречената болест „луда крава“. През 1985 година Администрацията по храните и лекарствата на САЩ забранява употребата на ЧХР от трупове. По едно щастливо съвпадение, рекомбинантният ЧХР на Genentech, който не носи риск от зараза, е одобрен за използване през същата година.
През първата фаза на биотехнологичната индустрия повечето компании се съсредоточават върху протеини с известни функции. Клонираният човешки инсулин няма как да не е успешен; хората си инжектират инсулин в една или друга форма вече повече от петдесет години, когато Genentech въвежда своя продукт. Друг пример е епоетин алфа (ЕПО), белтък, стимулиращ тялото да произвежда червени кръвни телца. Потребители на ЕПО са пациентите, подлагани на хемодиализа, които страдат от анемия в резултат от загуба на червени кръвни телца. За да посрещне тази нужда, Amgen в Южна Калифорния и „Институтът по генетика“ разработват рекомбинантна форма на ЕПО. ЕПО е полезен и комерсиално жизнеспособен продукт; не се знае само коя компания ще заеме доминиращо положение на пазара. Макар и обучен на мистериозните тънкости на физикохимията, главният изпълнителен директор на Amgen, Джордж Ратман, се адаптира добре към боричкането в света на бизнеса. Конкуренцията изкарва на бял свят несъмнено неизтънчена страна от неговата личност: преговарянето с него е като борба с голяма мечка, чиито святкащи очи ви уверяват, че ви мачка само защото е принудена да го прави. Amgen и стоящият зад него гигант „Джонсън енд Джонсън“ печелят съдебната битка с „Института по генетика“ и сега ЕПО носи два милиарда долара годишно само на Amgen. Днес Amgen е най-големият играч в биотехнологичния залог, на стойност около шейсет милиарда долара.
След като пионерите в биотехнологиите прибраха „очевидните“ продукти — белтъци с известни физиологични функции като инсулин, т-ПА, ЧХР и ЕПО — дойде ред за втората, по-спекулативната фаза в индустрията. Щом изчерпаха сигурните победители, жадните за нови „златни мини“ компании започнаха да подкрепят възможните кандидати, дори малко вероятните. От знанието, че нещо действа, те преминаха просто към надеждата, че даден продукт ще върши работа. За жалост съчетанието от по-голяма несигурност, технически предизвикателства и законови изисквания, които трябва да се изясняват преди дадено лекарство да бъде одобрено от Администрацията по храните и лекарствата на САЩ, се отразиха отрицателно върху много обещаващи биотехнологични идеи.
Откриването на факторите на растежа — протеини, стимулиращи пролиферацията и оцеляването на клетките — предизвика пролиферацията на нови биотехнологични компании. Сред тях са нюйоркската Regeneron и Synergen в Колорадо, които се надяват да открият лечение за латералната миатрофична склероза или болест на Лу Гериг — ужасно дегенеративно заболяване на нервните клетки. Идеята им е прекрасна по принцип, но тогава все още не се знае много за начина, по който действат нервните фактори на растежа, за да бъдат тези опити нещо повече от изстрели в тъмното. Опитите върху две групи пациенти, страдащи от латерална миатрофична склероза, се провалят и заболяването си остава нелечимо и до днес. Експериментите обаче разкриват един интересен страничен ефект: тези, които вземат лекарството, отслабват. Случилото се след това е чудесна илюстрация как бизнесът в областта на биотехнологиите е в състояние да прави случайни открития: така днес Regeneron разработва модифициран вариант на лекарството като терапия за намаляване на телесното тегло.
Друго първоначално спекулативно начинание, станало свидетел на разбиването на много от комерсиалните си надежди, е техниката на моноклоналните антитела. Когато са изобретени в средата на седемдесетте години на XX век в лабораторията по молекулярна биология на Медицинския научен съвет на Великобритания в Кеймбриджкия университет от Сезар Милщейн и Жорж Кьолер, моноклоналните антитела са приветствани като нещо дългоочаквано, което ще промени лицето на медицината. Въпреки това, поради немислимо днес недоглеждане, Медицинският научен съвет на Великобритания не ги патентова. Едва сега, след десетилетия на разочарования, те започват да получават дължимото.
Антителата са молекули, произвеждани от имунната система, за да идентифицират организмите-нашественици и да се свързват с тях. Моноклоналните антитела, които произлизат от единия род произвеждащи антитела клетки, са антитела, програмирани да се свързват с определена цел. В мишките се произвеждат веднага, ако им бъде инжектиран материал от въпросната цел, което предизвиква реакция на имунната система, и развъждане кръвните клетки на мишките, произвели моноклоналните антитела. Тъй като моноклоналните антитела могат да разпознават специфични молекули и да се свързват с тях, надеждата е да се използват с извънредна точност срещу различни опасни нашественици — туморни клетки например. Този оптимизъм води до създаването на няколко компании за моноклонални антитела, които бързо се натъкват на пречки. Иронично, но най-значимата от тях е човешката имунна система, която разпознава моноклоналните антитела на мишките като чужди и ги унищожава, преди да успеят да се заемат със своите цели. Оттогава досега са изобретени няколко метода за „хуманизиране“ на моноклоналните антитела — да се заменят колкото може повече от мишите антитела с човешки компоненти. А последното поколение от моноклонални антитела представлява най-голямата разрастваща се област в биотехнологиите днес.
Centocor, разположена близо до Филаделфия, сега притежавана от „Джонсън енд Джонсън“, разработи ReoPro, моноклонално антитяло, характерно за един белтък на повърхността на тромбоцитите, които поощряват образуването на кръвни съсиреци. Като не позволява на тромбоцитите да се слепват, ReoPro намалява вероятността от смъртоносно образуване на съсиреци при подложените на ангиопластика пациенти например. Genentech, която никога не се бави при включването към високите биотехнологични залози, сега снабдява пазара с Herceptin, моноклонално антитяло, чиято цел са някои форми на рак на гърдата. Immunex в Сиатъл произвежда на базата на моноклоналните антитела Enbrel, лекарство срещу ревматоиден артрит — заболяване, което се свързва с наличието на огромни количества от белтъка фактор на туморната некроза (ФТН), свързан с управлението на имунната система. Enbrel действа, като улавя излишните молекули ФТН и не им позволява да предизвикват имунна реакция срещу тъканите в нашите стави.
Други биотехнологични компании се интересуват от клонирането на гени, чиито белтъчни продукти са потенциални цели за новите лекарствени препарати. Сред най-упорито търсените са гените за протеините, които обикновено се намират на повърхността на клетките и служат като рецептори за невротрансмитерите, хормоните и факторите на растежа. Именно чрез тези химически посланици човешкото тяло координира действията на всяка отделна клетка с действията на трилионите други клетки. Беше установено, че лекарствата, разработени сляпо в миналото чрез поредица от опити и грешки, вършат работата си като въздействат върху тези рецептори. Същото ново молекулярно разбиране обяснява защо толкова много от въпросните лекарства предизвикват странични ефекти. Рецепторите често принадлежат към големи семейства от подобни белтъци. Лекарството може действително да атакува свързания с въпросното заболяване рецептор, но същевременно не е изключено да въздейства и върху други подобни рецептори, като предизвиква странични ефекти. Интелигентното създаване на лекарства изисква по-конкретно насочване спрямо рецепторите, за да бъде блокиран само един от тях, нужния в дадения случай. Но, както стана и с моноклоналните антитела, великолепната на хартия идея често се осъществява трудно на практика и още по-трудно от нея могат да се спечелят големи пари.
Този депресиращ урок научи и наскоро създадената в Сан Диего компания SIBIA, свързана с Института „Солк“. Откриването на мембранните рецептори за невротрансмитера никотинова киселина, обещава пробив в лечението на Паркинсоновата болест, но, както се случва често в биотехнологиите, добрата идея е само началото на много дълъг научен процес. В крайна сметка, след като дава обещаващи резултати при маймуните, кандидатът за лекарство на SIBIA се проваля при хората.
Както неочакваното намаляване на телесното тегло, предизвикано от нервния фактор на растежа на Regeneron, пробивите в тази област също често се раждат благодарение на щастливо стечение на обстоятелствата, отколкото от рационални научни пресмятания. През 1991 година например, разположената в Сиатъл компания ICOS, ръководена от известния ни още от Amgen Джордж Ратман, работи с клас ензими, наречени „фосфодиестераза“, които разграждат на по-прости молекулите, сигнализиращи клетките. Целта е да бъде открито лекарство за понижаване на кръвното налягане, но едно от тестваните лекарства предизвиква изненадващ страничен ефект. Оказва се, че то може да се използва като „Виагра“-та при проблеми с ерекцията и откритието да се окаже спечелване на много по-голям джакпот, отколкото се е предвиждало първоначално при търсенето на другата терапия.[1]
Въпреки благодатния пазар за препарати за улесняване на ерекцията, не е изненадващо, че търсенето на лечение на рака остава главната движеща сила за биотехнологичната индустрия. Класическият, убиващ клетките подход при атакуването на рака, използващ радиацията и химиотерапията, неизменно убива също така и здравите нормални клетки и води до страшни странични ефекти. С разработването на ДНК методологии, изследователите най-сетне се приближават към изнамирането на лекарства, които атакуват само ключовите белтъци (много от които „фактори на растежа“ и техните рецептори по повърхността на клетките), които стимулират растежа и деленето на раковите клетки. Разработването на лекарство инхибитор за желаната цел, което не обезврежда същевременно други, жизненоважни протеини, е огромно предизвикателство дори за най-добрите в тази област. А несигурното пътуване от успешно клонираното лекарство до широкото му разпространение и достъпност, след като бъде одобрено от Администрацията по храните и лекарствата на САЩ, е истинска одисея, която рядко отнема по-малко от десет години.
Завършващите с успех истории все още са рядкост, но съм убеден, че ще стават все по-чести. Откритото от швейцарската компания Novartis лекарство Gleevec, действа срещу рака на кръвта, наречен хронична миелоидна левкемия (ХМЛ), като блокира конкретно стимулиращата растежа активност на рецепторните мембранни протеини, произвеждани в ненужно големи количества от раковите клетки от този тип. Ако се даде в началния етап на ХМЛ, Gleevec води обикновено до дълги, свободни от болестта ремисии, и в много случаи — до пълно излекуване. В някои нещастни случаи обаче, болестта се появява отново, когато новите мутации в гена, кодиращ протеините на мембранния рецептор, направят Gleevec неефикасен.
Едно от най-важните противоракови лекарства, насочени срещу определен протеин, може би е рецепторът за епидермалния фактор на растежа (ЕФР). Този рецептор често се наблюдава в много по-големи количества в раковите (особено при рак на гърдата и на белите дробове), отколкото в нормалните клетки, което навежда на мисълта, че не е изключено да се окаже победител като целево лекарство. Няколко мощни лекарства, блокиращи конкретно ЕФР, вече са в последния стадий на клинично тестване. Появата на целеви лекарства определено ще включи извънредно мощни оръжия в борбата срещу рака, но най-вероятно, след първоначалната ремисия, при много пациенти ще се появи рецидив, тъй като колонизиращите тялото ракови клетки ще започнат да се съпротивляват срещу тях.
Поради тази причина мнозина стигнаха до извода, че най-добрият и дългосрочен начин за справяне с раковите клетки може би ще бъде атакуването на пътищата им за снабдяване с хранителни вещества. Като всички клетки в тялото, и те се нуждаят от храна, за да растат, и я получават от кръвоносните съдове, които се появяват край тях. Ако се блокира нарастването на кръвоносните съдове в туморите, обслужваните от тях ракови клетки ще загинат от глад. Идеята, че малките тумори стават опасни едва след проникването в тях на новообразувани кръвоносни съдове (процес, наречен „ангиогенеза“), идва за първи път на Джуда Фолкман в началото на шейсетте години, когато отбива военната си служба във Военноморския институт за медицински изследвания край град Вашингтон. Преждевременно развиващ се син на равин от Охайо, Фолкман е първият, завършил Университета на Охайо и приет в Харвардското медицинско училище. Когато влиза в гимназията, вече е присъствал на операция на куче, а по време на следването си изобретява хирургическо съоръжение за охлаждане на черния дроб, когато притокът на кръв до него е спрян временно. На трийсет и четири години става най-младият професор по хирургия в историята на Харвардския университет. Анти-ангиогенезните идеи на Фолкман обаче не могат да бъдат изследвани по терапевтичен път преди направеното неотдавна откритие на три специфични фактора на растежа, играещи жизненоважна роля за растежа на ендотелните клетки, които подплатяват отвътре кръвоносните съдове. Разработените срещу тези фактори на растежа инхибитори, антиогенезните лекарства, може би ще се окажат ефикасни при много форми на рак. Четирийсетина години след първоначалното прозрение на Фолкман може би най-после ще бъдем в състояние в обозримо бъдеще да лекуваме повечето ракови заболявания, включително и развилите резистентност към най-добрите конвенционални противоракови лекарства.
Намиращата се край Сан Франциско фирма Sugen вече разработи две, високоспецифични лекарства от малки молекули, действащи срещу определени антиогенезни фактори на растежа и действащи като инхибитори при туморите при животни. Нито едно от лекарствата, давано отделно, засега не е доказало ефикасността си при напреднал рак при хората. Предварителната информация обаче, от експериментите с онко-мишки, извършени от Дъг Ханаан в Калифорнийския университет в Сан Франциско, навеждат на мисълта, че лекарствата на Sugen може би ще действат, ако се дават в комбинация. За жалост бъдещето на опитите с онко-мишки в Калифорнийския университет в Сан Франциско и навсякъде другаде е доста неясно и заплашено от диспута, предизвикан от агресивната политика на „Дю Пон“ за лиценза на онко-мишката.
Проникването на кръвоносните съдове в мишите тумори се предотвратява и с наскоро открита група протеини, които изглежда са естествено срещащи се инхибитори на образуване на кръвоносни съдове. Два такива белтъка, ангиостатин и ендостатин, изолирани от Майкъл О’Райли в лабораторията на Джуда Фолкман, сега се изпробват клинично. Макар да не присъстват в кръвта в достатъчно големи количества, за да бъдат извлечени за тестване при хората, процедурите с рекомбинантна ДНК позволяват и двата протеина да се произвеждат в клетки от дрожди в достатъчни за клинична употреба количества. И докато засега нито ангиостатинът, нито ендостатинът самостоятелно не са демонстрирали чудотворно въздействие върху рака при хората, опитите с мишки навеждат на мисълта, че както и с лекарствата на Sugen, скоро може би ще бъде открито ефикасно съчетаване на двете. През следващото десетилетие цяла виртуална армада от белтъчни и съставени от малки молекули инхибитори вероятно ще бъдат готови да се спуснат из системите на страдащите от рак, възпрепятствайки образуването на кръвоносни съдове преди туморите да са станали смъртоносни. А ако нарастването на туморите може да се управлява по този начин, нищо чудно да започнем да гледаме на рака така, както гледаме на диабета — като на болест, която може да се контролира, ако не и да се излекува напълно.
Тъй като рекомбинантните технологии ни позволяват да впрягаме клетките да произвеждат буквално всеки протеин, логично се налага въпросът: защо да се ограничаваме с лекарствата? Да вземем примера с паяжината. Нишките, които образуват радиалните спици на паяжината, са изключително здрави. Ако се сравнява с теглото, това влакно е пет пъти по-здраво от стоманата. Макар да съществуват начини паякът да бъде накаран да изплете повече паяжина, отколкото са непосредствените му нужди, опитите за създаване на паякови ферми за производство на паякова коприна се провалиха, защото тези същества имат прекалено силни териториални претенции, за да могат да се отглеждат масово. Сега обаче, гените за производство на копринен протеин вече са изолирани и могат да се вкарват в други организми, които ще играят роля на фабрики за паякова коприна. Тези изследвания се финансират от Пентагона, според който Спайдърмен има бъдеще в американската армия: може би един ден войниците ще слагат предпазни костюми от паякова коприна, служещи като броня.
Друга вълнуваща нова перспектива в биотехнологиите включва подобряването на естествените белтъци. Защо да се задоволяваме със замисъла на природата, до който се е достигало в някои случаи произволно или в резултат на вече несъществуващ еволюционен натиск, когато, благодарение на незначителни манипулации, може да получим нещо далече по-полезно? Вече сме в състояние да осъществяваме минимални промени в аминокиселинните последователности на съществуващите протеини. Ограничение за жалост налага липсата на информация за ефекта, който би оказала върху свойствата на белтъка промяната дори само на една аминокиселина във веригата.
Тук можем да се обърнем към примера на природата, за да намерим решението: известната като „насочена молекулярна еволюция“ процедура, ефикасно имитира естествения подбор. При естествения подбор новите варианти се генерират произволно от мутацията и след това се пресяват чрез конкуренцията между отделните индивиди; успешният и по-добре адаптираните варианти имат по-голям шанс да оцелеят и да допринесат за създаването на следващото поколение. Насочената молекулярна еволюция имитира този процес в епруветки. След използването на биохимични трикове за предизвикване на случайни мутации в гена за някой протеин, по-късно можем да имитираме генетична рекомбинация, за да накараме мутациите да създадат нови последователности. От получените нови белтъци нашата система избира тези, които се справят най-добре при конкретните условия. Целият цикъл се повтаря няколко пъти, като всеки път „успелите“ от предишния цикъл молекули се конкурират в следващия.
Не е нужно да търсим пример как действа насочената молекулярна еволюция по-далече от пералнята. Тук се случват катастрофи, когато една-единствена цветна дреха случайно се озове сред бялото пране: част от боята на червената тениска неизбежно се разтваря и преди да сте разбрали какво става, всички чаршафи в дома ви стават бледорозови. Ензимът пероксидаза, произвеждан естествено от вид гъба, има свойството да обезцветява разтворените от дрехите бои. Проблемът обаче е, че ензимът не може да действа в горещата сапунена среда на пералната машина. Чрез насочената молекулярна еволюция обаче, стана възможно да се подобри способността на ензима за справяне с тези условия: един специално „еволюирал“ ензим например демонстрира способността да издържи на температури, 174 пъти по-високи от тези, които издържа ензимът на въпросната гъба. И подобни полезни „еволюции“ не отнемат кой знае колко време. Естественият подбор продължава милиони години, докато насочената молекулярна еволюция в епруветките върши работата си за часове или дни.
Генетичните инженери осъзнаха рано, че технологиите им могат да въздействат благотворно и върху селското стопанство. Светът на биотехнологиите вече знае, че генетично модифицираните растения сега се намират в центъра на кръстосания огън на противоречивите мнения. Затова би било интересно да се отбележи, че един по-ранен принос към селското стопанство, а именно увеличаването на млеконадоя, също предизвиква протести.
Волският хормон на растежа (ВХР) е подобен в много отношения на човешкия, но в селското стопанство проявява ценен страничен ефект: увеличава производството на мляко при кравите. Разположената в Сейнт Луис селскостопанска химическа компания „Монсанто“ клонира гена на ВХР и произведе рекомбинантен ВХР. Кравите произвеждат естествено този хормон, но инжектирането на ВХР на „Монсанто“ увеличава млечната им продуктивност с около 10%. В края на 1993 година Администрацията по храните и лекарствата на САЩ одобри употребата на ВХР и през 1997 година вече около 20% от десетте милиона крави на нацията получаваха добавка от ВХР. Млякото, произведено и от получаващите, и от неполучаващите добавката крави, не се отличава по нищо: и в двата случая съдържа едно и също малко количество ВХР. Всъщност един от най-основателните аргументи срещу обозначаването на млякото като „с добавка на ВХР“ и „без добавка на ВХР“, е невъзможността да се различи млякото, получено от получавалите и неполучавалите допълнително ВХР крави, следователно няма как да се разбере дали написаното е вярно. Тъй като ВХР позволява на фермерите да постигат целите си за млеконадой с по-малко животни, той се отразява като цяло благотворно върху околната среда, защото води до намаляване размерите на млечните стада. Метанът, произвеждан от добитъка, допринася в значителна степен за парниковия ефект и намаляването числеността на стадата може да се отрази благотворно в перспектива върху глобалното затопляне. Метанът задържа топлината двайсет и пет пъти по-ефикасно от въглеродния двуокис, а пасящата крава произвежда средно по шестстотин литра метан на ден от газове, достатъчни за надуването на четирийсет балона за парти.
На времето бях изненадан, че ВХР предизвика такива протести от лобито, настроено против ДНК. Сега, когато наред са полемиките за генетично променените растения, разбрах, че професионалистите в създаването на пререкания могат да предизвикат проблем абсолютно от всяко нещо. Джереми Рифкин, най-отявленият враг на биотехнологиите, поставя началото на кариерата си като отричащ всичко през 1976 година, когато се чества двеста годишнината на САЩ. Той се възпротивява. След това насочва протестите си срещу ДНК. В средата на осемдесетте години той отговаря така на твърдението, че ВХР няма да зарази хората: „Аз ще направя от това въпрос! Ще открия нещо! Това е първият биотехнологичен продукт, излязъл навън и аз ще се боря срещу него.“ Така и направи. „Това е неестествено“ (но не може да се отличи от „естественото“ мляко). „Съдържа протеини, причиняващи рак“ (не съдържа, а и белтъците се разграждат в процеса на храносмилане). „Ще принуди дребния фермер да излезе от бизнеса“ (но, за разлика от много други нови технологии, не изисква значителни капиталовложения, така че няма дискриминация и срещу дребния фермер). „Ще увреди кравите“ (почти деветгодишният комерсиален опит с милиони крави доказа, че това не е вярно). В крайна сметка, подобно на протестите срещу рекомбинантните техники от Азиломарската епоха, дебатите започнаха да отмират, защото стана ясно, че нито един от мрачните сценарии на Рифкин не издържа проверката на времето.
 Джереми Рифкин, професионалист в казването на „не“. Генетично модифицираните храни са последният му кръстоносен поход.
Джереми Рифкин, професионалист в казването на „не“. Генетично модифицираните храни са последният му кръстоносен поход.
Полемиките около ВХР дадоха известна представа за онова, което предстоеше. За Рифкин и останалите ДНК-фоби ВХР беше само ордьовър: основното блюдо на протестиращите щяха да бъдат генетично модифицираните храни.