Метаданни
Данни
- Включено в книгата
- Оригинално заглавие
- DNA: The Secret of Life, 2003 (Пълни авторски права)
- Превод отанглийски
- Красимира Матева, 2004 (Пълни авторски права)
- Форма
- Научен текст
- Жанр
- Характеристика
-
- Няма
- Оценка
- 5,6 (× 12гласа)
- Вашата оценка:
Информация
Издание:
Джеймс Д. Уотсън, Андрю Бери. ДНК — Тайната на живота
Редактор: Таня Боянова
Коректор: Ангелина Вълчева
Дизайн на корицата: Бисер Тодоров
Предпечат: Таня Петрова, Бисер Тодоров
ИК „ИнфоДАР“ ЕООД, 2004 г.
ISBN: 954-761-148-8
История
- —Добавяне
Четвърта глава
Игра на богове: Модифициране на молекулите на ДНК
 Лаборатория със затвор P4, свръхобезопасената апаратура за биомедицински изследвания върху смъртоносни микроби като бактерията Ebola или разработването на биологично оръжие. В края на седемдесетте години на XX век, с помощта на методите на генното инженерство, от изследователите на човешката ДНК също се изисква да използват лаборатория P4.
Лаборатория със затвор P4, свръхобезопасената апаратура за биомедицински изследвания върху смъртоносни микроби като бактерията Ebola или разработването на биологично оръжие. В края на седемдесетте години на XX век, с помощта на методите на генното инженерство, от изследователите на човешката ДНК също се изисква да използват лаборатория P4.
Молекулите на ДНК са изключително дълги. Във всяка хромозома има само една дълга двойна спирала ДНК. Популярните коментатори обичат да сравняват големината на тези молекули с броя на номерата в телефонния указател на Ню Йорк или с дължината на река Дунав. Подобни сравнения не ми помагат, защото нямам представа колко са телефонните номера в указателя на Ню Йорк, а споменаването на Дунав пробужда в мен по-скоро мелодията на някой Щраусов валс, отколкото усещане за дължина.
Като се изключат половите хромозоми X и Y, човешките се номерират според размерите. Хромозома 1 е най-голямата, а хромозоми 21 и 22 са най-малките. В хромозома 1 се намират 8% от общата ДНК на всяка клетка или около двеста и петдесет милиона базови двойки. Хромозоми 21 и 22 съдържат съответно около 40 и 45 милиона базови двойки. Дори най-малките ДНК молекули, тези от малките вируси, съдържат не по-малко от няколко хиляди базови двойки.
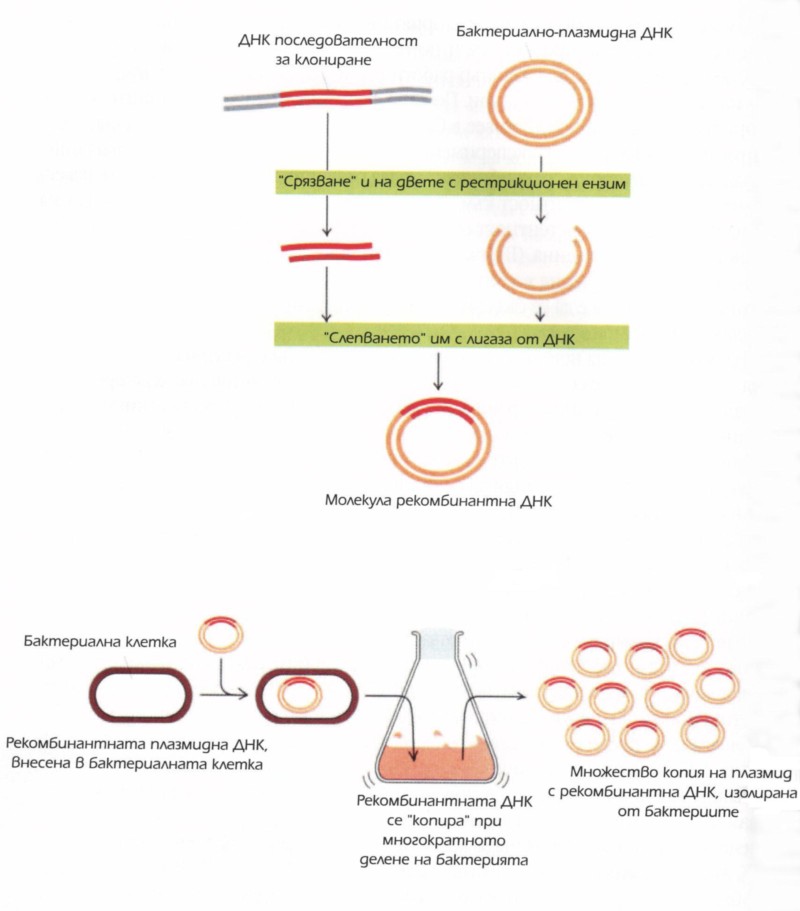
Огромният размер на ДНК молекулите създава голям проблем в ранните дни на молекулярната биология. За да разгадаем даден ген — определена част от ДНК — трябваше да изнамерим начин да го изолираме от останалата ДНК, която се разпростираше във всички посоки. Но тук не ставаше въпрос само за изолирането на гена; нуждаехме се също така от начин да го „умножаваме“: да се сдобием с достатъчно голяма мостра от него, с която да бъдем в състояние да работим. С други думи, нуждаехме се от система за молекулярно редактиране, от молекулярни ножици, които да нарязват ДНК текста на секции, с които можем да се справяме; нещо като молекулярно лепило, с чиято помощ да се манипулират тези парченца; и най-накрая, машина за молекулярно дублиране, за да умножаваме изрязаните и изолираните части. Искахме да правим нещо подобно на това, което върши редактиращата програма на компютъра: да режем, лепим и копираме ДНК.
Разработването на основните инструменти за изпълнението на тези процедури изглеждаше доста сложно за осъществяване дори след като проникнахме в генетичния код. Откритията, осъществени в края на шейсетте и началото на седемдесетте години се обединиха през 1973 година, за да ни дадат тъй наречената „рекомбинантна ДНК“ технология — възможността за „редактиране“ на ДНК. Това не беше обичаен напредък в областта на лабораторните техники. Внезапно учените вече бяха в състояние да обработват молекулите ДНК, създавайки такива, каквито не бяха откривани досега в природата. Можехме да си „играем на Господ“ с молекулярната основа на живота. Това бе смущаваща идея за мнозина. Джереми Рифкин, който непрестанно биеше тревога, тъй като виждаше във всяка нова генетична технология заплаха от създаване на ново чудовище на доктор Франкенщайн, отбеляза, че рекомбинантната ДНК „може да се сравни по значимост с откриването на огъня“.
Артър Корнбърг пръв „създава живот“ в епруветка. Както вече видяхме, през петдесетте година на XX век той открива ДНК полимеразата — ензимът за репликиране на ДНК чрез образуването на допълващо копие от отворената като цип „родителска“ верига. По-късно той работи с форма на вирусова ДНК и в крайна сметка успява да предизвика репликацията на всичките 5 300 базови двойки на ДНК на вируса. Но продуктът не беше „жив“; макар и идентична на родителската, получената ДНК последователност беше биологически инертна. Нещо липсваше. Липсващата съставка остана мистерия до 1967 година, когато Мартин Гелерт от Националните здравни институции и Боб Лемън в Станфорд я идентифицират едновременно. Този ензим е наречен „лигаза“. Лигазата прави възможно „слепването“ на краищата на молекулата ДНК.
Корнбърг успява да репликира вирусната ДНК, използвайки ДНК полимераза и, като добавя лигаза, да съедини двата края, така че цялата молекула да образува непрекъсната примка, както в оригиналния вирус. Сега „изкуствената“ вирусна ДНК се държи точно както естествената: вирусът нормално се размножава в E.coli и ДНК молекулата в епруветката на Корнбърг прави именно това. Използвайки само два ензима, някои основни химически съставки и вирусната ДНК, от която да направи копие, Корнбърг произвежда биологично активна молекула. Медиите съобщават, че е създал живот в епруветка, вдъхновявайки президента Линдън Джонсън да обяви пробива за „грандиозно постижение“.
Приносът на Вернер Арбър за развитието на технологиите за рекомбинантната ДНК през шейсетте години на XX век е по-неочакван. Швейцарският биохимик Арбър се интересува не толкова от големите въпроси за молекулярната основа на живота, а от озадачаващия аспект на естествената история на вирусите. Той изучава процеса, чрез който някои вирусни ДНК се разлагат след вкарването им в клетките на бактериалния приемник. Някои, но не всички (иначе вирусите не могат да се възпроизвеждат) клетки на приемника разпознават ДНК на определени вируси като чужди и селективно ги атакуват. Но как и защо? Всичките ДНК по света са все същата основна молекула, независимо дали се намира в бактерии, вируси, растения или животни. Кое възпрепятства бактериите да атакуват собствената си ДНК така, както атакуват вирусовата?
Първият отговор идва при откриването от Арбър на нова група разграждащи ДНК ензими — рестрикционни ензими. Тяхното присъствие в бактериалните клетки ограничава растежа на вируса като изрязва чуждата ДНК. Това отрязване на ДНК е специфична за последователността реакция: даден ензим отрязва ДНК само когато разпознае определена последователност. EcoR1, един от първите открити рестрикционни ензими, разпознава и отрязва конкретната последователност от базите ГААТТЦ.
Но защо тази бактерия не изрязва собствената си ДНК на всяко място, където се появи въпросната последователност ГААТТЦ? Тук Арбър прави второ голямо откритие. Заедно с рестрикционния ензим за определени последователности, бактерията произвежда и втори ензим, който модифицира химически същите тези последователности навсякъде, където се появят в собствената му ДНК[1]. Модифицираните ГААТТЦ последователности, присъстващи в бактериалната ДНК, остават неразпознати от EcoR1, който междувременно изрязва въпросната последователност навсякъде, където се появи във вирусната ДНК.
Следващата съставка на революцията на рекомбинантната ДНК се разбира при изследването на бактериалната резистентност към антибиотици. През шейсетте години се установява, че много бактерии развиват резистентност към даден антибиотик не по стандартния начин (чрез мутация в бактериалния геном), а посредством внасянето на иначе чужда част от ДНК, наречена „плазмид“. Плазмидите са малки пръстени ДНК, които живеят в бактериите и се репликират и предават заедно с останалата част от бактериалния геном при клетъчното делене. При определени обстоятелства плазмидите могат да се предават също така от бактерия на бактерия, позволявайки на реципиента да придобие незабавно неполучена при „раждането“ му генетична информация. Тази информация често включва гените, придаващи резистентност към антибиотици. Естественият подбор, наложен от антибиотиците, е в полза на бактериалните клетки, разполагащи с резистентния фактор (плазмида).
Стенли Коен от Станфордския университет е пионер на плазмидите. Благодарение на насърчението на гимназиалния си учител по биология, Коен избира медицината. При дипломирането в медицинското училище плановете му да практикува като лекар по вътрешни болести се отлагат за неизвестно бъдеще, но перспективата да бъде мобилизиран като лекар в армията го вдъхновява да приеме поста на изследовател в Националните здравни институции. И скоро открива, че предпочита изследователската пред лекарската дейност. Прави големия си пробив през 1971 година, когато изнамира метод за внасяне на плазмиди в бактериални клетки от E.coli. Всъщност Коен трансформира E.coli-те така, както Фред Грифит преди четирийсет години преобразува щамовете несмъртоносни бактерии в смъртоносни чрез превземането на ДНК. В случая на Коен обаче, именно плазмидът, с антибиотичната резистентност на своите гени, е превзет от щам, който преди това е бил податлив на антибиотика. Щамът щеше да остане резистентен към антибиотика в продължение на поколения, като плазмидът в ДНК се предава невредим при всяко делене не клетката.
В началото на седемдесетте години всички съставки, изграждащи рекомбинантната ДНК, са вече по местата си. Първо успяхме да срежем ДНК молекулите, използвайки рестрикционни ензими, и да изолираме интересуващите ни последователности (гени); после, с помощта на лигаза, можахме да „слепим“ тази последователност в плазмид (който по този начин служи като флопи диск, съдържащ желаната от нас последователност); най-сетне успяхме да копираме нашата част от ДНК, вкарвайки същото това плазмидно флопи в бактериалната клетка. Обикновено клетъчното делене се грижи за репликацията на плазмида с нашето парченце ДНК така, както и за наследения генетичен материал на клетката. Така, започвайки само с един плазмид, трансплантиран в една клетка, при размножаването си бактерията може да произведе огромно количество от избраната от нас ДНК последователност. Ние оставихме бактерията да се възпроизвежда и възпроизвежда, образувайки в крайна сметка неизброима бактериална колония от милиарди бактерии, тъй като същевременно създавахме милиарди копия от нашето парченце ДНК. По този начин колонията се превърна в наша фабрика за ДНК.
Трите компонента — рязане, слепване и копиране — се срещат през ноември 1972 година в Хонолулу. Поводът е конференцията, посветена на плазмидите. Младият професор Хърбърт Бойър, наскоро назначен в Калифорнийския университет в Сан Франциско, присъства на нея, както и един от пионерите на плазмидите, Стенли Коен. И двамата са израснали на Източното крайбрежие. Бивш гимназиален футболист от Западна Пенсилвания, Бойър може би е имал късмет, че треньорът му е също така и преподавател по естествени науки. И той като Коен е от новото поколение учени, израснали с двойната спирала. Ентусиазмът му във връзка с ДНК дори го вдъхновява да нарече сиамските си котки Уотсън и Крик. Никой, и със сигурност не и треньорът, не се изненадва, когато след завършване на колежа той решава да специализира по въпросите на бактериалната генетика.
Макар да работят в Сан Франциско, Бойър и Коен не се познават преди Хавайската конференция. Бойър вече е специалист по рестрикционните ензими в епоха, когато малцина са чували за тях: именно той и неговите колеги наскоро бяха разбрали кое е мястото на срязването на последователността на ензима EcoR1. Бойър и Коен скоро си дават сметка, че с обединените си умения са в състояние да изведат молекулярната биология до ново ниво — света на срязването, лепенето и копирането. Една вечер те остават до късно в закусвалня край Уайкики, като мечтаят за раждането на технологията на рекомбинантната ДНК и нахвърлят идеите си върху книжни салфетки. Това, изпълнено с нови идеи и предположения картографиране на бъдещето, е описано като „от соленото говеждо до клонирането“.
Само след няколко месеца лабораторията на Бойър в Сан Франциско и тази на Коен, намираща се четирийсет мили по на юг в Пало Алто, вече си сътрудничат. Естествено, лабораторията на Бойър работи върху рестрикционния ензим, а на Коен — върху плазмидните процедури. По една случайност един от техниците в лабораторията на Коен, Ани Чанг, живее в Сан Франциско и може да пренася скъпоценния товар на напредващите експерименти между двете места. Целта на първия опит е създаването на хибрид, „рекомбинант“ от два различни плазмида, за които е известно, че придават резистентност към определен антибиотик. В единия плазмид има ген, част от ДНК, за резистентност срещу тетрациклина, а генът в другия е за резистентност срещу канамицина. (В началото, както може да се очаква, бактерията-носител на първия вид плазмид е убита от канамицина, а тази с втория вид е убита от тетрациклина.) Целта е да се създаде един „суперплазмид“, придаващ резистентност и срещу двата антибиотика.
Първо и двата вида непроменени плазмиди са срязани с рестрикционни ензими. След това плазмидите се смесват в една епруветка и се добавя лигаза, за да предизвика слепването на срязаните краища. За част от молекулите в сместа лигазата става причина просто някои от срязаните плазмиди да възвърнат целостта си — двата края на въпросния плазмид се слепват. Понякога обаче, благодарение на лигазата, се случва някой от срязаните плазмиди да се съедини с парченце ДНК от другия вид плазмид и в резултат се получава желаният хибрид. Щом това бъде постигнато, следващата стъпка е трансплантирането на всички плазмиди в бактерията чрез използването на триковете за внасяне на плазмиди на Коен. Отгледаните по този начин колонии се пренасят в петрита, намазани с тетрациклин и канамицин. Просто преобразуваните плазмиди пак проявяват резистентност към единия от антибиотиците; носещите тези плазмиди бактерии следователно няма да оцелеят в среда, в която присъстват и двата антибиотика. Ще оцелеят само бактериите с комбинирани плазмиди, тези, в които са представени и двата вида ДНК, единият, кодиращ резистентността към тетрациклина, и другият, кодиращ резистентността срещу канамицина.
Следващото предизвикателство бе създаването на хибриден плазмид, като се използва ДНК от напълно различен вид организъм, например човек. Един от първите успешни опити в тази област е вкарването на ген от африканска сухоземна жаба в плазмид от E.coli и трансплантирането на получения резултат в бактерия. При всяко делене, клетките в бактериалната колония удвояват вкарания сегмент от жабешка ДНК. Ако използваме доста объркващата терминология на молекулярната биология, ние бяхме „клонирали“ ДНК на жаба.[2] ДНК на бозайниците също се оказа забележително податлива на клониране. И това не е чак толкова изненадващо: частта от ДНК в крайна сметка пак е ДНК, химическите й свойства са същите, независимо от източника. Скоро става ясно, че протоколите за клониране на фрагменти от плазмидна ДНК и на Коен, и на Бойър ще вършат чудесна работа и когато става дума за ДНК от всяко същество.
И така, бе поставено началото на втората фаза от революцията в молекулярната биология. През първата фаза целта ни беше да опишем как работи в клетката ДНК; сега, с рекомбинантната ДНК[3], разполагахме със средства, за да се намесим, да манипулираме ДНК. Докато изследвахме възможността да „играем на Господ“, бяхме създали условия за бърз прогрес. Неописуемо вълнуващо бе да имаш невероятния потенциал да проникваш все по-дълбоко в мистериите на живота и възможностите за осъществяване на реален напредък в борбата срещу болести като рака. Но дали, наред с отварянето на очите ни за невероятните научни перспективи, Коен и Бойър не бяха отворили кутията на Пандора? Имаше ли все още неоткрити опасности в молекулярното клониране? Трябваше ли да продължаваме бодро да вкарваме части от човешка ДНК в E.coli-те, преобладаващия вид в микробната джунгла в нашите черва? Ами ако променените форми намереха начин да проникнат в телата ни? Накратко, можехме ли с чиста съвест да пренебрегваме предупрежденията на хората, според които създавахме бактериални Франкенщайновци?
 Чревният микроб E.coli. Ако си направи труда да погледне, човек ще открие около десет милиона от тях във всеки грам човешки изпражнения.
Чревният микроб E.coli. Ако си направи труда да погледне, човек ще открие около десет милиона от тях във всеки грам човешки изпражнения.
През 1961 година от бъбреците на малка индийска маймунка, с цел приготвянето на ваксина срещу полиомиелит, е изолиран вирус, наречен SV40 (SV е абревиатура от „simian virus“ или „маймунски вирус“). Смята се, че вирусът не въздейства върху маймуните, в които се среща естествено. Опитите обаче скоро показват, че може да причини рак у гризачите и, при определени лабораторни условия, дори в човешките клетки. Тъй като програмата за ваксиниране срещу полиомиелит, влязла в сила от 1955 година, заразява милиони американски деца с вируса, това откритие поражда голяма тревога. Дали програмата за предпазване от полиомиелит не бе обрекла, без да иска, цяло едно поколение на рак? За щастие отговорът изглежда е „не“; не последва епидемия от ракови заболявания и SV40 очевидно се оказва не по-опасен за живите човешки същества, отколкото е за маймуните. Въпреки това, макар SV40 да присъства неизменно в лабораториите по молекулярна биология, останаха известни съмнения относно неговата безопасност. Аз бях особено притеснен, защото по онова време бях ръководител на лабораторията на Колд Спринг Харбър, където все повече млади учени работеха с SV40, за да изследват генетичната основа на рака.
Междувременно, в Медицинското училище на Станфордския университет, Пол Бърг се вълнуваше повече от обещанията, отколкото от опасностите, свързани със SV40; той предвиждаше възможността вирусът да се използва, за да се вкарат части от ДНК — чужди гени — в клетки на бозайници. Вирусът щеше да действа като молекулярна система за пренос при бозайниците, така както плазмидите бяха включени в действие при бактериите от Стенли Коен. Докато Коен използваше бактериите като копирни машини, Бърг виждаше в SV40 средство за вкарване на корективни гени в жертвите на наследствени заболявания. Бърг изпреварваше своето време. Той се стремеше към това, което днес наричат „генна терапия“: вкарване на нов генетичен материал в жив човек, за да се компенсират наследените му генетични недостатъци.
Бърг пристига в Станфорд като доцент през 1959 година, като част от договорката, която докарва там и по-известния Артър Корнбърг от Вашингтонския университет в Сейнт Луис. Връзката на Бърг с Корнбърг всъщност може да бъде проследена до общото им рождено място — Бруклин в Ню Йорк. Там всеки по своето време минава през същия гимназиален клуб по естествени науки, воден от някоя си мис Софи Улф. Бърг си спомня: „Тя правеше науката забавна, караше ни да споделяме идеите си.“ При това, очевидно, меко казано, защото клубът по естествени науки на мис Улф в гимназията „Ейбръхам Линкълн“ ражда трима Нобелови лауреати: Корнбърг (1959 г.), Бърг (1980 г.) и кристалографа Джером Карл (1985 г.), които единодушно признават нейния благотворен принос за това.
И докато Коен и Бойър, а сега вече и други, доизглаждат и доуточняват подробностите около срязването и слепването на ДНК молекулите, Бърг планира един наистина дързък експеримент: той смята да разбере дали SV40, в който е имплантирана част от чужда ДНК, може да бъде накаран да пренесе този чужд ген в животинска клетка. За удобство възнамерява да използва като източник на непроизлизащата от SV40 ДНК един леснодостъпен бактериален вирус — бактериофаг. Целта му е да види дали молекулата, съставена от ДНК на SV40 и ДНК на бактериофага, може да проникне успешно в животинска клетка. Бърг се надява, че ще може, защото тогава се открива потенциалната възможност да използва тази система, за да вкарва полезни гени в човешките клетки. През лятото на 1971 година, в лабораторията на Колд Спринг Харбър, специализант на Бърг прави презентация, за да обясни планирания експеримент. Един от присъстващите учени се притеснява достатъчно, за да се обади веднага на Бърг и да го попита какво ще стане, ако опитът протече обратно на предположенията. С други думи, какво ще стане, ако, вместо да вземе вирусната ДНК и да я вкара в животинската клетка, вирусът SV40 бъде манипулиран от бактериофагната ДНК и в резултат ДНК на SV40 проникне например в клетка на E.coli? Подобен сценарий не беше нереалистичен: все пак много бактериофаги са програмирани именно за това — да вкарват своята ДНК в бактериалните клетки. Тъй като E.coli са едновременно повсеместни и тясно свързани с хората като основен компонент на чревната им флора, добронамереният експеримент на Бърг можеше да доведе до създаването на опасни колонии от E.coli, носещи маймунския вирус SV40, потенциален раков агент. Бърг взе под внимание опасенията на своя колега, макар да не ги споделяше, и реши да отложи опита си дотогава, докато се научи повече за потенциала на SV40 да предизвиква рак у хората.
Опасенията за скрити биологични опасности следваха по петите и вестта за успеха на Бойър и Коен в процедурите им с рекомбинантна ДНК. На научната конференция в Ню Хампшир от есента на 1973 година, посветена на нуклеиновите киселинни, мнозинството гласува за петиция до Националната академия на науките да разследва без отлагане опасностите от новата технология. Година по-късно назначеният от Националната академия и председателстван от Пол Бърг комитет публикува своето заключение в едно писмо до списание „Сайънс“. Аз самият подписах това писмо като много други, в това число Коен и Бойър, които проявиха голяма активност във въпросното изследване. В станалото известно като „Писмото за мораториум“ ние призовахме „учените от целия свят“ да отложат доброволно рекомбинантните си изследвания, „докато потенциалните опасности от такива рекомбинантни ДНК молекули бъдат преценени по-добре или докато бъдат разработени адекватни методи за предотвратяване на тяхното разпространение“. Важен елемент в това изявление беше признанието, че „нашите притеснения се основават върху преценката за потенциалния, а не за демонстрирания риск, тъй като съществува много малко експериментална фактология за опасностите, криещи се в тези ДНК молекули“.
Съвсем скоро обаче започнах да се чувствам извънредно безпомощен и да изпитвам съжаление поради замесването си в „Писмото за мораториум“. Молекулярното клониране очевидно има потенциала да донесе много добро на света, но сега, след като бяхме работили така усилено и бяхме достигнали до ръба на биологичната революция, крояхме планове да се оттеглим. Беше объркващ момент. Както Майкъл Роджърс писа през 1975 година в доклада си за „Ролинг Стоун“: „Молекулярните биолози очевидно достигнаха до ръба на експерименталната пропаст, която в крайна сметка може да се окаже равностойна на тази, пред която се бяха изправили физиците в годините преди откриването на атомната бомба.“ Това проява на предпазливост ли беше или на малодушие? Все още не можех да кажа със сигурност, но започваше да ми се струва, че е второто.
Конгресът „Кутията на Пандора“, както го нарече Роджърс, събра през февруари 1975 година 140 учени от целия свят в конферентния център „Азиломар“ в Пасифик Гроув, Калифорния. Целта му беше да се реши веднъж завинаги дали рекомбинантната ДНК носи повече опасности, отколкото обещания. Трябваше ли да бъде постоянен мораториумът? Трябваше ли да упорстваме да вървим напред независимо от потенциалния риск, или да изчакаме първо да бъдат разработени предпазни средства? Като председател на организационния комитет, Пол Бърг беше също така ръководител на конференцията и като такъв осъществи почти невъзможната задача да се постигне консенсус при вземането на решение в края на срещата.
Представителите на пресата се почесваха по главите, докато учените общуваха на най-новия научен жаргон. Не липсваха и адвокати, за да ни напомнят, че засягаме също така и правни въпроси, като например дали от мен, като ръководител на лаборатория, извършваща рекомбинантни изследвания, щеше да се търси съдебна отговорност, ако някой от моите техници заболее от рак. Колкото до учените, те и по природа, и по навик не обичаха да рискуват да правят предсказания, когато липсват нужните познания; и съвсем основателно подозираха, че ще бъде невъзможно да се достигне до вземане на единодушно решение. Може би Бърг също имаше своите съмнения. Във всеки случай той заложи на свободата на изразяване пред твърдото лидерство от председателското място. Последвалият дебат беше открит за всички и нерядко отклоняваше от темата изказващи се, чието единствено желание бе да разкажат в подробности за важната работа, която се извършваше в тяхната лаборатория. Мненията варираха в необхватно широки граници, от плахото „да се продължи мораториума“, до невъздържаното „по дяволите мораториумът, нека да продължаваме да се занимаваме с наука“. Аз клонях определено към тази част от спектъра. Вече смятах, че е по-безотговорно да се отлагат изследванията заради някакви неизвестни и неокачествими опасности. Имаше толкова отчаяно болни хора, страдащи от рак или кистозна фиброза… Какво ни даваше правото да ги лишаваме от единствената им надежда?
Сидни Бренър, който по това време живееше и работеше във Великобритания, в Кеймбридж, предложи един от малкото уместни факти. Беше събрал колонии от щама на E.coli, известен като К-12 — любимия бактериален черноработник при изследването на този вид клониране. Особени редки щамове E.coli понякога предизвикват хранителни натравяния, но огромното мнозинство E.coli са безвредни и Бренър предполагаше, че К-12 не прави изключение. Интересуваше го не собственото му здраве, а здравето на К-12 — дали би могла да оцелее извън лабораторията. Той разбърква микробите в чаша прясно мляко (сервирани натюр те не са никак приятни на вкус) и изгълтва гадната смес. И проследява това, което излиза от другия край, за да разбере дали клетките К-12 са успели да колонизират червата му. Отговорът е отрицателен и навежда на мисълта, че К-12, макар и да процъфтява в епруветките, не е жизнеспособен в „естествения“ свят. Някои обаче поставят под въпрос така направения извод: бактериите К-12 може и да не са оцелели, но това все още не доказва, че не са разменили плазмиди — или друга генетична информация — с щамове, способни да живеят съвсем добре в червата ни. Следователно, подложените на въздействие чрез генното инженерство гени пак могат да навлязат в популацията от обитаващи червата бактерии. След това Бренър започна да пропагандира идеята, че трябва да разработим щам К-12, способен да живее извън лабораторията. Можехме да го постигнем чрез генетична промяна, която да подсигури растежа на щама само при наличие на конкретни хранителни съставки. И, разбира се, щяхме да се погрижим тези хранителни съставки никога да не се срещат при естествени условия; осигуряването на пълния им набор щеше да бъде възможно само при лабораторни условия. Модифицираната по такъв начин К-12 щеше да бъде „безопасна“ бактерия, жизнеспособна единствено при контролираните от нас условия и обречена в реалния свят.
 Дебатите за ДНК: Макет Сингър, Нортън Зиндър, Сидни Бренър и Пол Бърг са се счепкали по спорните въпроси по време на конференцията в „Азиломар“.
Дебатите за ДНК: Макет Сингър, Нортън Зиндър, Сидни Бренър и Пол Бърг са се счепкали по спорните въпроси по време на конференцията в „Азиломар“.
Умерената идея на Бренър в крайна сметка бе приета. Поддръжниците на двете крайности, естествено, мърмориха доста, но в крайна сметка конференцията приключи с приемането на препоръки, позволяващи продължаването на изследванията върху „обезвредени“, неболестотворни бактерии, и като задължи да се използват скъпи, херметически съоръжения при работата с ДНК на бозайници. Тези препоръки щяха да образуват основата на Инструкциите за изследване на рекомбинантна ДНК, издадени година по-късно от Националните здравни институции.
Тръгнах си паднал духом, чувствайки се изолиран от повечето си колеги. За Стенли Коен и Хърб Бойър случилото се също беше обезсърчаващо; и те като мен смятаха, че много от нашите колеги бяха действали срещу здравия си разум като учени, само за да бъдат видени от събралите се представители на пресата като „добрите“ (а не като потенциални Франкенщайновци). Огромното мнозинство всъщност никога не бе работило с болестотворни организми и почти не разбираше какво означават ограниченията върху изследванията, които искаха да наложат върху работещите с такива организми. Смущаваше ме произволността на много от нещата, за които се бяхме споразумели: ДНК от студенокръвни гръбначни например бе обявена за „приемлива“, а ДНК от бозайници — за недопустима за повечето учени. Очевидно беше безопасно да се работи с ДНК на жаба, но не и на мишка. Поразен от тази глупост, реших да не остана назад и попитах какво ще правим с жабите, след като те причиняват поява на брадавици. Но шеговитите ми възражения бяха напразни.
Насоките накараха много от участниците в Азиломарската конференция да очакват ясни и точни указания за клонирането на „безопасни бактерии“. Но всички, останали с подобно впечатление, скоро трябваше да се разочароват. Според логиката, поддържана от популярната преса, ако самите учени виждаха повод за тревога, тогава масите би трябвало да бъдат истински притеснени. Все още не бяха изминали дните на американската контракултура, макар вече да отзвучаваха. От войната във Виетнам и политическата кариера на Никсън не ни делеше кой знае колко време. Подозрителните маси, лишени от възможността да разберат сложните въпроси, които науката тепърва започваше да проумява, жадно поглъщаха теориите за злонамерени конспирации. От своя страна ние, учените, с изненада установихме, че ни причисляват към елита, към който никога досега не бяхме подозирали, че принадлежим. Дори Хърб Бойър, истинският модел за учен-хипи, бе определен в специалното издание за Хелоуин на „Бъркли Барб“, ъндърграундския вестник в региона на Бей, като един от регионалните „десетима най-големи вампири“, чест, която иначе се пазеше за корумпирани политици и незачитащи профсъюзите капиталисти.
Най-големият ми страх беше, че тази обществена параноя към молекулярната биология ще доведе до драконовски мерки от страна на законовите органи. Определянето на всичко, което бе позволено и забранено в експерименталната област във вид на обременителен законов правилник, щеше да се отрази наистина зле върху науката. Планирането на експериментите щеше да зависи от политическите настроения и цялата безнадеждна бюрокрация, следваща неизменно подобен род действия, щеше да ни разяде както бяха направили молците в бабиния гардероб. Междувременно опитите ни за преценка на реалния потенциален риск, произтичащ от нашата работа, се възпрепятстваха от пълната липса на факти и от логическото затруднение да се потвърди едно отрицание. Никога досега не бяхме ставали свидетели на катастрофа, свързана с рекомбинантната ДНК, но пресата продължаваше да надминава себе си в изобретяването на сценарии за това, което би могло да стане „в най-лошия случай“. В разказа си за една среща от 1977 година във Вашингтон, окръг Колумбия, биохимикът Лион Хепъл умело обобщава абсурдите, на които ставаха свидетели учените в целия този спор.
Чувствах се така, както бих се чувствал, ако бях избран за някой ad hoc[4] комитет, свикан от правителството на Испания, за да опита да прецени риска, който поема Христофор Колумб със своите моряци, комитет, който да определи какво би трябвало да се прави, ако Земята се окаже плоска, колко още може да продължава нататък екипажът, без да рискува да изпадне от ръба на Земята и тъй нататък.
Но дори изпепеляващата ирония не бе в състояние да възпре хората, твърдо решили да се противопоставят на това, което според тях бе проява на Прометеевско високомерие в науката. Един от тези кръстоносци бе Алфред Велучи, кметът на Кеймбридж, Масачузетс. Велучи се бе сдобил с политическа власт, поддържайки обикновения човек за сметка на елитните образователни институции на града — Масачузетския технологичен институт и Харвард. Бурята около рекомбинантната ДНК се превърна за него в златна политическа мина. Едно описание от онова време предава доста точно това, което става.
С плетената си жилетка с цвят на червени боровинки, черен панталон и синя риза на жълто райе, правеща отчаяни опити да прикрие биреното му коремче, и дори с кривите си зъби и натъпкани до краен предел джобове, Ал Велучи е въплъщение на чувството на безсилие на средния американец при вида на тези учени, на тези технократи, на тези умни негодници, на тези харвардски интелектуалчета, които си мислят, че дърпат света на конци като марионетка и ще го пуснат да падне в някоя по-кална локва. И кой се озовава в крайна сметка в калта? Не интелектуалчетата. Не, това винаги са Ал Велучи и обикновените работещи хора, оставени да бършат сами калта от себе си.
Откъде се взе тази разгорещеност? Учените от Харвард изразиха желанието си да изградят на територията на учебното заведение херметическо съоръжение за работата с рекомбинантната ДНК съгласно новите Инструкции на Националните здравни институции. Но, видял в това шанса си и подкрепян от ляво ориентираната клика в Харвард и Масачузетския технологичен институт със своя анти-ДНК план, Велучи успя да прокара неколкомесечна забрана върху всички изследвания на рекомбинантна ДНК в Кеймбридж. Резултатът беше краткотрайно, но ясно изразено изтичане на мозъци, тъй като биолозите от Харвард и Масачузетския технологичен институт се насочиха към места с не толкова политически нажежен климат. Междувременно Велучи се радваше на новопридобитата си известност като пазител на обществото от науката. През 1977 година той писа до президента на Националната академия на науките:
В днешния брой на „Бостън Хералд Американ“ има два репортажа, които ме засягат силно. В Доувър, Масачузетс, е забелязано „странно създание с оранжеви очи“, а в Холис, Ню Хампшир, един мъж и двамата му синове се натъкнали на „космато, високо девет фута същество“. С уважение моля вашите институции да разследват тези случаи. Надявам се също така да проверите дали тези „странни създания“ (ако съществуват действително), не са свързани по някакъв начин с експериментите с рекомбинантна ДНК, осъществявани в региона на Ню Ингланд.
 Изслушване на свидетели в Кеймбридж, Масачузетс, което доведе до забрана в целия град на изследванията върху рекомбинантната ДНК.
Изслушване на свидетели в Кеймбридж, Масачузетс, което доведе до забрана в целия град на изследванията върху рекомбинантната ДНК.
Въпреки всичко, опитите да бъде накарано националното законодателство да ограничи опитите с рекомбинантна ДНК, за щастие не доведоха до резултат. Сенаторът Тед Кенеди от Масачузетс се включи в крамолата доста рано, като събра Сената, за да изслуша свидетелите само месец след Азиломар. През 1976 година той писа до президента Форд, за да изкаже мнението си, според което правителството би трябвало да контролира както индустриалните, така и академичните изследвания на ДНК. През март 1977 година аз свидетелствах пред законодателното тяло на щата Калифорния. Сред присъстващите беше губернаторът Джери Браун, и така ми се удаде възможност да го посъветвам лично да не допуска грешката да предприема правни действия, освен в случай на неочаквано заболяване на учените в Станфорд. Ако работещите с рекомбинантна ДНК запазеха доброто си здравословно състояние, за обществото щеше да бъде по-добре правораздаващите органи да се фокусират върху по-очевидни опасности за общественото здраве, като карането на велосипед.
С осъществяването на все повече експерименти, както в съответствие с Инструкциите на Националните здравни институции, така и с тези, наложени от съответните органи в други страни, ставаше все по-очевидно, че процедурите с рекомбинантна ДНК не създават Франкенмикроби (още по-малко, въпреки мнението на мистър Велучи, „странни създания с оранжеви очи“). През 1978 година можах да напиша: „В сравнение с почти всеки друг обект, започващ с буквата «Д», ДНК е действително извънредно безопасна. Много по-основателно е да се тревожим за неща като динамит, диелдрин, диоксин, делириум или джебчии, отколкото да се чертаят сложни схеми, обясняващи как произведената в лабораториите ДНК ще доведе до унищожаването на човешкия род.“
По-късно същата година, във Вашингтон, Консултативният комитет по рекомбинантна ДНК към Националните здравни институции (НЗИ) предложи далече не толкова ограничаващи инструкции, които щяха да позволяват работата с рекомбинантната ДНК в по-голямата си част, включително и с изследването за търсене на ДНК на туморен вирус, да напредва. А през 1979 година Джоузеф Калифано, министър на здравеопазването, образованието и социалните грижи, одобри промените и така сложи край на периода на безсмислена стагнация в изследването на рака при бозайниците.
Резултатът от консенсуса от Азиломар в крайна сметка не се оказа нищо повече от пет тъжни години на отлагане на важни изследвания и петгодишно обезсърчаващо прекъсване на кариерата за много млади учени.
С настъпването на края на седемдесетте години спорният въпрос, повдигнат от първоначалните експерименти на Коен и Бойър, постепенно се превърна в неспорен. Бяхме принудени да направим никому ненужна заобикалка, но поне това доказа желанието на молекулярните учени да бъдат социално отговорни.
Молекулярната биология не бе извадена обаче напълно от релси от политиците през втората половина на седемдесетте години на XX век; тези години станаха свидетели на важен напредък, в повечето случаи градящ се върху все още спорната технология за молекулярно клониране на Бойър-Коен. Най-значимият пробив беше изобретяването на методи за разчитане последователността на ДНК. Секвенционирането зависи от наличието на голямо количество от интересуващата ви част от ДНК, затова не беше приложимо, освен в случаите с малка вирусна ДНК, преди развитието на технологиите за клониране. Както видяхме, клонирането включва вкарването на желаната част от ДНК в плазмид, който след това се вкарва в бактерия. На бактериите се дава възможност да растат и да се делят, за да произведат множество копия на фрагмента от ДНК. След като бъдат събрани от бактериите, въпросните фрагменти от ДНК вече са узрели за секвенциониране.
Бяха разработени едновременно две техники за секвенциониране — едната от Уоли Гилбърт в Кеймбридж, Масачузетс (Харвард), а другата от Фредерик Санджър в Кеймбридж, Англия. Интересът на Гилбърт към секвенционирането на ДНК произлизаше от факта, че бе изолирал репресорния протеин в управляващата система на β-галактозидазния ген в E.coli. Той показа, че репресорът се свързва с ДНК близо до гена, предотвратявайки транскрипцията му във веригите РНК. Сега той искаше да узнае последователността на този участък от ДНК. Случайната среща с бляскавия съветски химик Андрей Мирзабеков подсказа на Гилбърт начин — чрез използването на определени мощни комбинации от химикали — да прекъсва веригите ДНК точно на желаните места с определени бази.
През последната година от гимназиалното си обучение във Вашингтон, Гилбърт си спестява някои часове, за да ходи да чете трудове по физика в библиотеката. Той се стреми към Свещения Граал на всички гимназиални вундеркинди в областта на естествените науки: наградата „Уестингхаус“[5] за намиране на таланти. Гилбърт спечелва своята награда през 1949 година. (Години по-късно, през 1980 година, когато му се обаждат от Шведската академия в Стокхолм, се потвърждава статистическият факт, че спечелването на наградата „Уестингхаус“ е един от най-сигурните предвестници за бъдещ нобелист.) След следдипломната си специализация по физика, Гилбърт се присъединява към физическия факултет в Харвард през 1956 година, една година след отиването ми там. Но щом го заинтригувах с лабораторните си изследвания на РНК, той изостави своето поле на дейност в полза на моето. Съобразителен и непримирим, оттогава Гилбърт е неизменно в първите редици на молекулярната биология.
От двата метода за секвенциониране обаче, създаденият от Санджър по-успешно издържа изпита на времето. С някои от разграждащите ДНК химикали, необходими за Гилбъртовия, се работи трудно; при първа възможност те ще започнат да разграждат ДНК на изследователя. Методът на Санджър, от друга страна, използва ензима, който копира ДНК в клетките при естествени условия — ДНК полимераза. Неговият трик включва правенето на копие от леко променените базови двойки. Вместо да използва само нормалните дезокси бази (А-та, Т-та, Г-та и Ц-та), откривани при нормални условия в ДНК (дезоксирибонуклеиновата киселина), Санджър прибавя някои тъй наречени дидезокси бази. Дидезокси базите имат особено свойство: ДНК полимеразата охотно ще ги включи в нарастващата ДНК верига (тоест копието се монтира като допълнение на веригата от шаблона), но след това не може да добави други бази към веригата. С други думи, дубликатната верига не може да се удължи по-нататък от дидезокси базата.
Да вземем модел, чиято последователност е ГГЦЦТАГТА. В експеримента се използват много, много копия от тази верига. Сега си представете, че веригата се копира, като се използва ДНК полимераза в присъствието на смесица от нормално А, Т, Г и Ц, плюс дидезокси А. Ензимът ще копира, прибавяйки първо Ц (за да отговаря на първоначалното Г), после друго Ц, после Г и друго Г. Но когато ензимът стигне до първото Т, има две възможности: да добави към нарастващата верига или нормално А, или дидезокси А. Ако избере дидезокси А, веригата няма да може да се разраства повече и резултатът ще бъде къса верига, завършваща с дидезокси А (ддА): ЦЦГГддА. Ако се случи да добави нормално А, тогава полимеразата на ДНК може да продължи да прибавя бази: Т, Ц и тъй нататък. Следващата вероятност за дидезокси „спиране“ от този род няма да дойде преди ензимът да достигне следващото Т. Тук отново той може да добави или нормално А, или ддА. Ако добави ддА, резултатът е отново прекратена верига, но все пак малко по-дълга от първата: тази верига има последователност ЦЦГГАТЦддА. И това се повтаря всеки път, когато ензимът срещне Т (тоест има възможност да добави А към веригата); ако случайно подбере нормално А, веригата продължава да се уголемява, ако се спре на ддА, веригата свършва тук.
Какво ни дава всичко това? В края на експеримента разполагаме с огромно количество вериги с различна дължина, копирани от шаблонната ДНК. Кое е общото при тях? Всички те завършват с ддА.
Сега да си представим този процес, осъществен за всяка една и от останалите три: бази; в случая с Т, например, използваме смес от нормални А, Т, Г и Ц плюс ддТ и получените молекули ще бъдат или ЦЦГГАддТ или ЦЦГГАТЦАддТ.
След като организирахме протичането на реакцията по всичките четири начина — веднъж с ддА, веднъж с ддТ, веднъж с ддГ и веднъж с ддЦ — разполагахме с четири набора ДНК вериги: при единия веригите завършваха с ддА, при другия — с ддТ и тъй нататък. Ако сега успеехме да сортираме всички тези минивериги според респективните им, леко вариращи дължини, можехме да влияем върху последователността. Как ли? Един момент, моля. Първо нека видим как бихме могли да осъществим сортирането. Нека поставим всички фрагменти от ДНК в чиния, пълна със специална пихтиеста утайка и да поставим чинията в електрическо поле. Под влияние на електрическото поле молекулите ДНК ще бъдат принудени да мигрират из утайката, а скоростта на придвижване на отделната миниверига ще бъде функция от нейните размери: късите вериги се движат по-бързо от по-дългите. След определен интервал от време, най-малката миниверига, в нашия случай проста ддЦ, ще се е придвижила най-далече; следващата по големина, ЦддЦ, ще е изминала малко по-кратко разстояние; следващата, ЦЦддГ, още мъничко по-кратко разстояние. Сега вече трикът на Санджър би трябвало да ви се е изяснил: след установяването на относителното положение на всички тези минивериги при ограниченото във времето надбягване през пихтиестата утайка, ще можем да влияем върху последователността на нашата част от ДНК: първо е Ц, после е друго Ц, после е Г и тъй нататък.
През 1980 година Санджър подели Нобеловата награда за химия с Гилбърт и Пол Бърг, за когото тя бе признание за приноса в развитието на технологиите с рекомбинантна ДНК (Необяснимо защо, нито Стенли Коен, нито Хърб Бойър бяха удостоени с тази награда.)
Това беше втората Нобелова награда за Санджър.[6] Беше получил Нобелова награда за химия през 1958 година, за изобретяване на метод за секвенциониране на белтъците, тоест за определяне последователността на техните аминокиселини, и прилагането му във връзка с човешкия инсулин. Не съществува обаче никаква връзка между метода му за секвенциониране на протеини и метода за секвенциониране на ДНК; нито технически, нито теоретично едното може да помогне за създаването на другото. Той измисли и двете от нулата и може би на него трябва да се гледа като на най-висшия технически гений от ранната история на молекулярната биология.
Санджър няма нищо общо с онова, което може би очаквате от един двоен Нобелов лауреат. Роден в квакерско семейство, той става социалист и осъзнато се противопоставя на Втората световна война. И, колкото и невероятно да звучи, не търси да получи дивиденти от своите достижения и предпочита да държи Нобеловите си отличия на съхранение: „Имаш хубав златен медал, който е в банката. И сертификат, който е на тавана.“ Дори отказа честта да получи почетното звание „сър“: „Това звание те прави по-различен, нали? Аз пък не желая да бъда различен.“ След като се пенсионира, Санджър с радост се грижи за градината си в околностите на Кеймбридж, въпреки че от време на време все още се появява, скромно и изпълнен с бодрост, в центъра „Санджър“, посветен на геномното секвенциониране и отворен край Кеймбридж през 1993 година.
Секвенционирането щеше да потвърди едно от най-забележителните открития на седемдесетте години на XX век. Вече знаехме, че гените са линейни вериги от А-та, Т-та, Г-та и Ц-та и че тези бази се транслират едновременно по три, в съответствие с генетичния код, за да създават линейните вериги от аминокиселини, които наричаме „протеини“ или „белтъци“. Но забележителните изследвания на Ричард Робъртс, Фил Шарп и други разкриха, че в много организми гените съществуват всъщност на парчета, като жизненонеобходимото кодиране на ДНК е прекъснато от части неуместна ДНК. Едва след като информационната РНК бъде транскрибирана, хаосът се подрежда чрез процеса на „редактиране“, който елиминира неуместните части. Подобно би било положението, ако тази книга съдържа чужди, странични параграфи, явно вмъкнати произволно, посветени на бейзбола или на историята на Римската империя. Уоли Гилбърт нарича нарушаващите реда последователности „интрони“, а отговарящите за самото протеиново кодиране (тоест представляващи функционална част от гена) — „екзони“. Оказва се, че интроните са по принцип характерни за сложните организми и не са открити в бактериите.
Някои гени са изключително богати на интрони. Например при хората, генът за съсирването на кръвта фактор VIII (който може да бъде мутирал при хората с хемофилия), има двайсет и пет интрона. Фактор VIII е голям протеин, дълъг около две хиляди аминокиселини, но кодиращите го екзони съставляват едва 4% от цялата дължина на гена. Останалите 96% от гена са изградени от интрони.
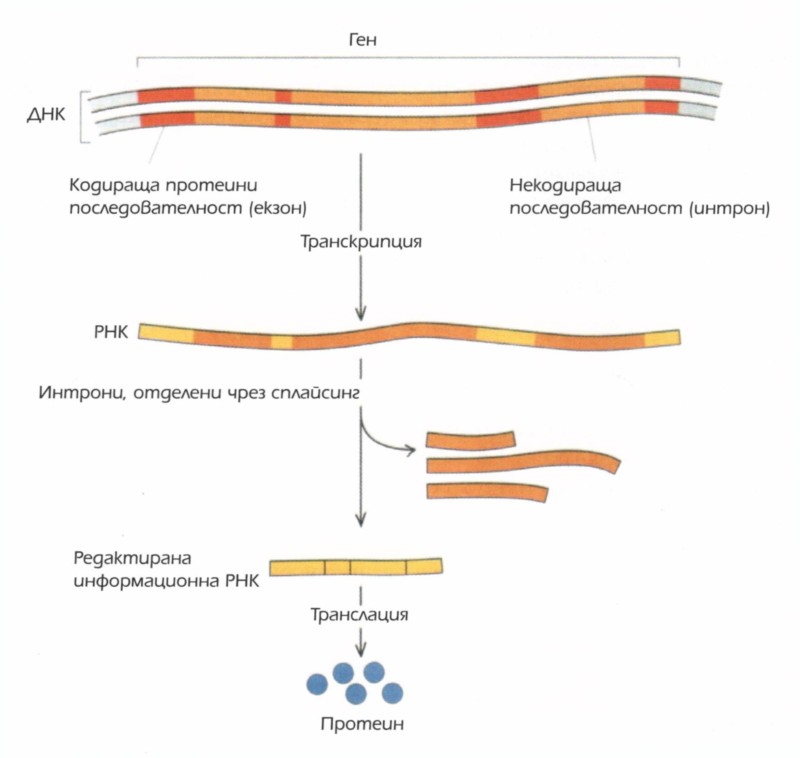 Интрони и екзони. Некодиращите интрони се редактират от информационната РНК преди производството на белтъци.
Интрони и екзони. Некодиращите интрони се редактират от информационната РНК преди производството на белтъци.
Защо в такъв случай съществуват интроните? Очевидно тяхното присъствие усложнява значително клетъчните процеси, защото те трябва вечно да се редактират, за да образуват информационната РНК; а това редактиране явно не е лесно, особено като се има предвид, че една-единствена грешка при отстраняването на даден интрон от информационната РНК на, да речем, съсирващия фактор VIII, най-вероятно ще доведе до изместваща рамката мутация, която ще направи получения по този начин белтък безполезен. Според една от теориите тези молекулярни нашественици са просто остатък от миналото, еволюционно наследство, останало от ранните дни от живота на Земята. Все още предизвиква много спорове въпросът как са се появили интроните и каква роля играят, ако изобщо играят някаква роля, във великия код на живота.
След като си изяснихме общата природа на гените в еукариотите (организми, чиито клетки съдържат отделение — ядрото, специализирано за складиране на генетичния материал; прокариотите, като бактериите, са без ядро), започна истинска научна златна треска. Екипи от пламенни учени, въоръжени с последните технологии, се впуснаха в гонитбата кой пръв ще изолира (клонира) и определи характеристиките на гена. Сред първите открити съкровища бяха гените, мутациите в които предизвикват рак при бозайниците. Веднъж щом завършиха секвенционирането на ДНК на няколко добре изучени туморни вируса, сред които и SV40, учените бяха в състояние да посочат съвсем точно гените-причинители на рака. Тези гени са способни да превърнат нормалните клетки в такива, притежаващи ракови свойства, например със склонност към неконтролируем растеж и клетъчно делене, характерни за туморите. Не след дълго учените вече изолираха гени от човешки ракови клетки и най-сетне потвърдиха предположението, че ракът при хората се проявява поради промяна в нивото на ДНК, а не просто поради негенетични инциденти в растежа. Открихме гени, които ускоряват или поощряват растежа на рака, и гени, които го забавят или възпрепятстват. Както изглежда, клетката, също като автомобила, се нуждае и от педал на газта, и от спирачка, за да функционира както трябва.
Търсенето на съкровища в генетиката не остави равнодушна и молекулярната биология. През 1981 година лабораторията в Колд Спринг Харбър започна летен курс за напреднали, запознаващ с технологиите за клониране на гени. От разработения в резултат на този курс лабораторен наръчник, „Молекулярно клониране“, през следващите три години се продадоха над осемдесет хиляди екземпляра. В първата фаза от ДНК революцията (1953–1972 г.), вълнението, предизвикано от откриването на двойната спирала и довело до генетичния код, участваха около три хиляди учени. През втората фаза обаче, открита от рекомбинантната ДНК и технологиите за секвенциониране на ДНК, този брой нарасна стократно за малко повече от десет години.
Това бурно разрастване е отражение отчасти на раждането на една съвсем нова индустрия: биотехнологията. След 1975 година ДНК не вълнуваше вече само научните среди, опитващи да проумеят молекулярната основа на живота. Молекулите излязоха извън научната обител, изпълнена с хора с бели престилки, и навлезе в съвсем различен свят, населен до голяма степен от хора с копринени вратовръзки и класически костюми. Името Франсис Крик, дало на дома му в Кеймбридж названието „Златната спирала“, вече имаше съвсем ново значение.