Метаданни
Данни
- Включено в книгата
- Оригинално заглавие
- DNA: The Secret of Life, 2003 (Пълни авторски права)
- Превод отанглийски
- Красимира Матева, 2004 (Пълни авторски права)
- Форма
- Научен текст
- Жанр
- Характеристика
-
- Няма
- Оценка
- 5,6 (× 12гласа)
- Вашата оценка:
Информация
Издание:
Джеймс Д. Уотсън, Андрю Бери. ДНК — Тайната на живота
Редактор: Таня Боянова
Коректор: Ангелина Вълчева
Дизайн на корицата: Бисер Тодоров
Предпечат: Таня Петрова, Бисер Тодоров
ИК „ИнфоДАР“ ЕООД, 2004 г.
ISBN: 954-761-148-8
История
- —Добавяне
Дванайсета глава
Предизвикателство към болестите: Лечение и предотвратяване на генетичните заболявания
 Дейвид Ветър, чието вродено заболяване на имунната система го прави податлив на най-незначителната зараза, е отгледан в този стерилен свят и се превръща в оригиналното „момче от мехура“.
Дейвид Ветър, чието вродено заболяване на имунната система го прави податлив на най-незначителната зараза, е отгледан в този стерилен свят и се превръща в оригиналното „момче от мехура“.
От момента на раждането си, Дейвид Ветър никога не е усетил директното докосване на друго човешко същество. Той страда от вродено заболяване, известно като тежък комбиниран синдром на имунен дефицит (ТКСИД). Неспособността на тялото му да произвежда Б и Т клетки, изключително важни елементи за имунната реакция към болестите, го прави податлив и на най-слабата инфекция.
Родителите на Дейвид знаят още преди раждането му, че може да има ТКСИД: първородният им син е умрял от това. Семейство Ветър и лекарите са готови. И решават предварително, ако се окаже, че бебето наистина страда от ТКСИД, да бъде изолирано в стерилна обстановка, докато бъде открито лечение; те не се съмняват, че това ще стане скоро, като гледат бързия напредък на медицината. Дейвид се ражда с цезарово сечение през септември 1971 година и веднага е поставен в стерилен инкубатор. Контактът с него се осъществява единствено чрез гумените ръкавици, вградени в малката камера. Детето расте и го местят във все по-големи найлонови „мехури“, остава само една константа: гумените ръкавици. Те са единственият му начин да усети някого или нещо от външния свят.
Очакваното лекарство така и не е открито. Дейвид остава в своя мехур, където привлича внимание в национален мащаб. НАСА опитва да му помогне, като му осигурява подвижна биологична изолационна система, в същността си нещо като скафандър, който му дава възможност да напуска понякога своя мехур. Но скафандърът е в действителност просто мехур от друг тип.
Напредъкът в трансплантацията на костен мозък изглежда обещаващ и през октомври 1983 година, месец след дванайсетия му рожден ден, на Дейвид е трансплантиран костен мозък от по-голямата му сестра. За нещастие се оказва, че костният й мозък съдържа вирус и в резултат в беззащитния организъм на Дейвид се развива злокачествен лимфом. През февруари 1984 година той трябва да напусне своя мехур, за да влезе в интензивното отделение. Умира малко след това, но поне през последните си дни има най-после възможността да усети топлината на човешкото докосване.
Можем да бъдем благодарни, че ТКСИД се среща рядко, но генетичните заболявания са изненадващо често явление сред децата. Около 2% от всички бебета се раждат с някаква сериозна генетична аномалия. Смята се, че гените са директно отговорни за една десета от постъпванията в детските болници и индиректно свързани с около половината. Случаят на Дейвид Ветър ни дава представа докъде достигат познанията ни за вродените заболявания: можем да разберем какво не е наред и можем да ги диагностицираме, но почти не сме в състояние да ги третираме, още по-малко — да ги излекуваме.
Интересно е да се проследи представата за ТКСИД в популярната култура. През седемдесетте години заболяването вдъхновява достойния за телевизията предизвикващ сълзи филм „Момчето в найлоновия мехур“. През деветдесетте „момчето в мехура“ се превръща в забавна фигура в телевизионния сериал „Сейнфелд“. А през 2001 година „Дисни“ пуска безвкусен филм, представящ поредица от глупави приключения от живота на момче, затворено в мехур вследствие на неназовано, но нямащо как да бъде сбъркано заболяване.[1] Това продължително безсилие на науката пред лицето на една ужасна болест в известна степен сигурно е отговорно за тази широка гама от опити за представянето й, вариращи между сантиментализъм и фарс. Но същото безсилие прави болестта още по-трудна за понасяне от засегнатите и техните семейства. Особено при болестите, при които състоянието се влошава прогресивно и необратимо, диагнозата е равносилна на смъртна присъда. Когато няма лечение, някои биха предпочели да не узнаят очакващата ги ужасна съдба, особено ако вече са станали свидетели на пораженията й в обичани от тях хора. В предишната глава се запознахме с Нанси Уекслър; заради 50% вероятност да бъде застигната от болестта на Хънтингтън, покосила майка й и вуйчовците й, Уекслър работи дълго и усилено край езерото Маракайбо и генетичните лаборатории на Съединените щати, за да открие виновния ген. И въпреки че в резултат на героичните й усилия той бе наистина изолиран и идентифициран, лечение все още не е открито. Макар да направи толкова много за създаването на диагностичен тест, Уекслър заяви, че не желае да се тества, поне не и преди появата на лекарство, на което да може да се разчита. Тя предпочита да живее в огромна несигурност, отколкото да открие истината: вероятността да не е наследила гена е равна на вероятността да се превърне в умствена и физическа черупка на динамичната жена, която е сега.
Понякога е по-непоносимо да се грижиш за страдащ от подобно заболяване, отколкото да заболееш сам от него. Каръл Кар от Хамптън, Джорджия, става свидетелка как съпругът й Хойт е повален от болестта на Хънтингтън на трийсет и няколко години. Сестра му Рослин умира от нея, а брат му Джордж се самоубива малко след като е диагностициран. Каръл напуска работа и се превръща в болногледачка на Хойт през следващите двайсет години, докато той се разпада малко по малко. При диагностицирането на Хойт, двамата имат вече трима сина, и когато той умира през 1995 година, Каръл вече е болногледачка и на двамата по-големи сина, Ранди и Анди, и, както и съпруга си, трябва да ги храни и къпе, да им дава лекарството, да им помага да ходят в тоалетната. Скоро и Джеймс, най-малкият, също проявява симптомите. Отчаяна, Каръл неохотно дава Ранди и Анди в дома за хора в тяхното състояние и там ги застрелва и двамата на 8 юни 2002 година. „Ню Йорк Таймс“ публикува мнението на Джеймс, че болестта на Хънтингтън е убила братята му много преди неговата майка, с разбито от цялото това нещастие сърце, да натисне спусъка.
Не всички генетични заболявания са трагедии на медицинската безпомощност. Може би най-добрият пример за противното е болестта, отговорна за странното предупреждение, изписано с дребен шрифт върху опаковката на някои хранителни продукти, особено безалкохолни напитки: „Съдържа фенилаланин“. Фенилаланинът е аминокиселина, разпространена съставка на белтъците, която не може да бъде обработвана от хората с вроденото заболяване, наречено „фенилкетонурия“ (ФКУ).
Историята започва в Норвегия през 1934 година. Една млада майка е твърдо решена да разбере какво не е наред с двете й деца, на четири и на седем години, изглеждали напълно нормални при раждането. По-голямото все още не се е научило да не извършва винаги нуждите си в панталоните и е в състояние да изговаря само няколко думи, но не и да състави цяло изречение. Случаят привлича вниманието на Асбьорн Фьолинг, биохимик и лекар. След като провежда поредица от изследвания, той открива биохимична аномалия и я свързва със състоянието им: децата имат прекалено много фенилаланин в урината си. Но научава също така, че техният случай не е единствен: открива трийсет и четири други случая в двайсет и две семейства в Норвегия и си дава сметка, че се е натъкнал на генетично заболяване.
Вече знаем, че ФКУ се причинява от мутация в гена за фенилаланин хидроксилаза, ензимът, който преобразува фенилаланина в друга аминокиселина — тирозин. Това рядко заболяване поразява около 1 на 10 000 човека в Северна Америка и се наследява по рецесивен модел: човек трябва да има две мутирали копия на гена, по едно от всеки родител, за да заболее от ФКУ. При засегнатите деца, които нямат функциониращ ензим, фенилаланинът се натрупва в кръвта, възпрепятства развитието на главния мозък и води до тежки умствени увреждания. Профилактиката е проста: децата с ФКУ, отгледани от раждането с бедна на фенилаланин храна (с минимално количество белтъци и без безалкохолни напитки с изкуствени подсладители, двата основни източника), израстват нормални. Само по себе си храненето е разделителната линия между нормалното мозъчно развитие и сериозната умствена инвалидност. Очевидно е много важно да се разбере ФКУ статуса на детето веднага след раждането му. Робърт Гътри изобретява прост диагностичен тест за нивото на фенилаланина в кръвта и неуморно пропагандира употребата му, докато се превръща в стандартна практика за новородени. От 1966 година от петата на всяко новородено се взема кръвна проба и се изследва за нивото на фенилаланин. Така, без да изследва нито една базова двойка от ДНК, тестът на Гътри проверява за вродено заболяване милиони бебета ежегодно. Преди въвеждането на тази програма за тестване, 1% от случаите на умствено изоставане в Съединените щати се дължеше на ФКУ, докато сега те са само няколко на година.
През петдесетте години на XX век се развива цитогенетиката: изучаване на хромозомите под микроскоп. Използван в диагностиката, този метод скоро разкрива, че аномалиите в броя на хромозомите — обикновено един повече или по-малко — неизменно причиняват сериозна дисфункция. Проблемите произлизат от липсата на баланс в броя на гените — отклонение от нормата човек да притежава по две копия от всеки ген. Тези състояния не се предават в семействата като мускулната дистрофия на Дюшен или кистозната фиброза, но са пак генетични; те възникват спонтанно при инциденти в клетъчното делене, водещо до образуването на сперматозоиди и яйцеклетки.
Най-добре познат е синдромът на Даун, наречен на името на Джон Лангдън Даун, който през 1866 година, като директор на дома за бавноразвиващи се пациенти, пръв описва характерните му клинични особености. Той забелязва, че 10% от обитателите в неговата институция си приличат: „Това бе така подчертано, че когато застанеха един до друг, трудно можеше да се повярва, че не са деца на едни родители.“ Но първите прозрения за биологичната основа на болестта идват едва деветдесет години по-късно, когато френският лекар Жером Льожьон открива, че децата със синдрома на Даун имат три копия на една хромозома — хромозома 21 — както се установява по-късно. Нормалното състояние, две копия от една хромозома, се нарича „дизомия“; така че синдромът на Даун е известен като „тризомия 21“.
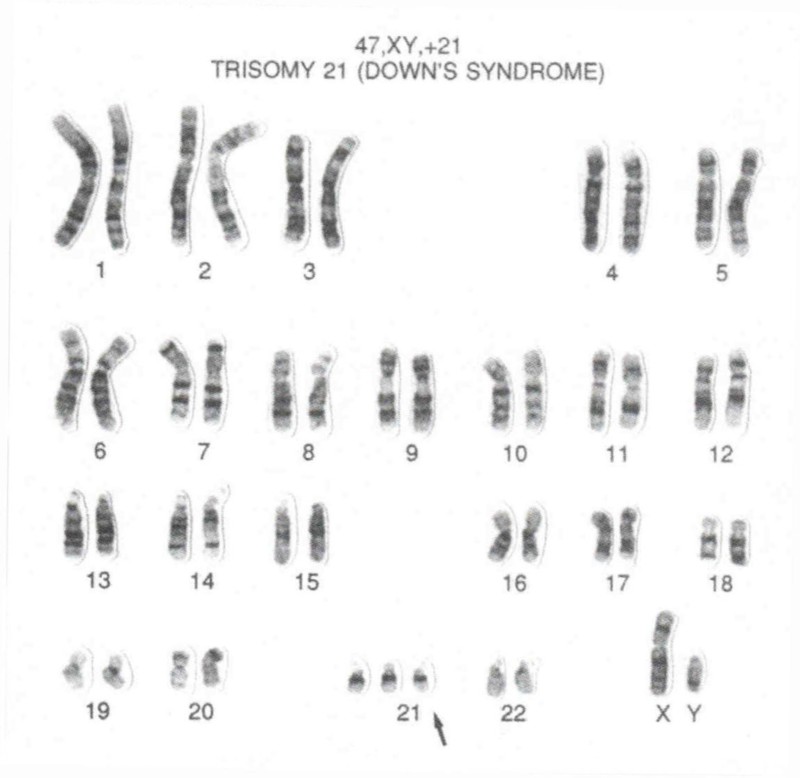 Кариотип — пълният комплект хромозоми — на мъж със синдрома на Даун. Обърнете внимание на допълнителното копие на хромозома 21.
Кариотип — пълният комплект хромозоми — на мъж със синдрома на Даун. Обърнете внимание на допълнителното копие на хромозома 21.
Случаите на раждане на деца със синдрома на Даун нарастват успоредно с увеличаване възрастта на майката. Вероятността двайсетгодишната майка да роди бебе със синдром на Даун е 1:1 700; при жените на трийсет и пет тя скача на 1:400; а при четирийсет и пет — 1:30. Поради тази причина много по-възрастни бременни жени предпочитат на плода в утробата им да се направи пренатален скрининг, за да се определи дали няма трето копие на хромозома 21. Тестът е направен за първи път през 1968 година и днес се предлага рутинно на всички бременни жени над трийсет и петгодишна възраст.
Тъй като развиващият се зародиш трябва да бъде достатъчно голям, за да издържи на извличането на тъканна проба, диагностицирането не може да се извърши в най-ранния етап на бременността. Обикновено то се прави между петнайсетата и осемнайсетата седмица на бременността чрез амниоцентеза, процедура, при която се изтегля околоплодна течност (където обикновено се съдържат клетки от плода). При алтернативния тест, който може да се извърши още през десетата седмица, се събират клетки от хорионните въси, частта от плацентата, която се залавя за маточната стена, но този метод е по-несигурен. Тъй като и двете процедури носят известен риск — амниоцентезата води при 1% от случаите до помятане, а вземането на проба от хорионните въси — в 2% от случаите — обикновено съветват по-младите жени да ги избягват: вероятността плодът да има генетичен дефект е по-малка от вероятността да бъде увреден от процедурата. Преди извлечените клетки от зародиша трябваше да се отглеждат в епруветки, преди да се пристъпи към анализ на хромозомите. Днес е възможно анализът да се извърши по-бързо, като се използва ин сито флуоресцентна хибридизация. При този метод, малка флуоресцентна молекула се закрепва за участък от ДНК последователността, специфична за хромозома 21, и се въвежда в пробата, където се свързва с хромозома 21 на зародиша. Ако в ядрото на някоя клетка се появят две светещи петънца, плодът е нормален; ако са три, плодът има синдром на Даун.
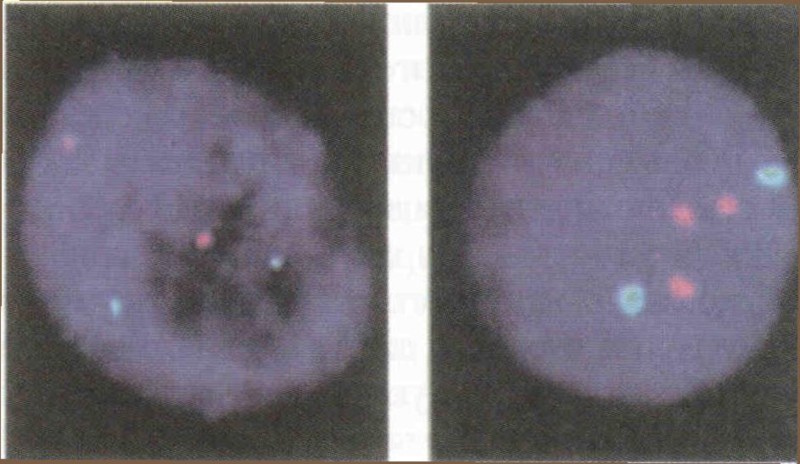 Флуоресцентно оцветяване за откриване броя на хромозомите. Ядрото на клетката (тъмносиньо) се сондира за хромозома 10 (светлосиньо) и хромозома 21 (розово). Вляво е показан нормален кариотип с две копия от всяка хромозома; вдясно обаче виждаме Даун кариотип, с допълнително копие на хромозома 21.
Флуоресцентно оцветяване за откриване броя на хромозомите. Ядрото на клетката (тъмносиньо) се сондира за хромозома 10 (светлосиньо) и хромозома 21 (розово). Вляво е показан нормален кариотип с две копия от всяка хромозома; вдясно обаче виждаме Даун кариотип, с допълнително копие на хромозома 21.
Във Великобритания 30% от Дауновите бременности се установяват чрез рутинното тестване на 5% по-възрастни жени, ставащи майки. Този метод показва несъмнена ефективност, изчислена въз основа на установените случаи, разделени на изразходваните лири (Министерството на здравеопазването на Великобритания е принудено да прави подобни изчисления непрекъснато, откакто мисис Тачър атакува разходите за здравеопазването), но какво става с останалите 70% от случаите на синдром на Даун? Той се среща значително по-рядко при младите жени, но пък именно те представляват основният процент бъдещи майки. Тъй като статистиката показва, че рискът от стандартните тестове е по-голям от риска да се роди бебе със синдром на Даун, правят се опити да бъдат открити алтернативни, неагресивни индикатори. Оказва се, че откритите в майчината кръв вещества дават полезна информация. Ниското ниво на алфа-фетопротеин и високото на хорионен гонадотропин, са свързани в значителна степен със синдрома на Даун (макар в никакъв случай да не са непременно индикатори за тризомия). И сега се практикува следното: на младите жени се предлага да се направи тази кръвна проба и ако тя говори за възможност от синдром на Даун, ги съветват да се подложат на амниоцентеза или вземане на проба от хорионните въси, за да се направи окончателна диагноза.
Все още обаче науката не е успяла да се пребори със следния много тъжен факт: съвременната жена, научила, че плодът в утробата й има синдром на Даун, може да избира между две неща: да стане майка на дете с това заболяване или да направи аборт. Вземането на подобно мъчително решение в никакъв случай не се улеснява от факта, че синдромът на Даун се проявява в различна степен. Всички засегнати от него хора имат специфичните характеристики на лицето, описани от доктор Даун — широко плоско лице, малък нос и тесни очни цепки[2] — но коефициентът им на интелигентност варира в широки граници, от 20 до 85 (тоест от сериозни умствени увреждания до долната граница на нормалното). Те са особено податливи към някои болести, включително сърдечни (които поразяват около 15% от родените със синдрома на Даун още през първата година от живота), стомашно-чревни аномалии, левкемия и, с увеличаването на възрастта, катаракти и Алцхаймер; но е напълно възможно човекът да има и сравнително малко здравословни проблеми. Благодарение на по-добрите грижи и познания относно риска за здравето, създаван от наличието на тази допълнителна хромозома, средната продължителност на живота им се увеличи значително: днес 50% от хората със синдрома на Даун навършват петдесет години. Въпреки че в типичния случай повечето от тях с времето постигат смятаната за депресираща от повечето хора „фамилиарност с болничните заведения“, те обикновено имат възможност да се насладят на живота и създават радост за не едно семейство. Това състояние е може би по-трудно за родителите, които трябва да свикнат да се грижат за човек със специални медицински нужди, както и с мисълта, че детето им, в много отношения, никога няма да порасне.
В повечето случаи жените, научили, че плодът в утробата им е със синдром на Даун, предпочитат да прекратят бременността си[3] В резултат в страните, където пренаталният скрининг е рутинна процедура, раждането на бебета със синдром на Даун намалява. Статистически обаче, това твърдение е по-сложно, отколкото изглежда: модата да се отлага майчинството, често поради професионални съображения, доведе до увеличаване броя на жените, изложени на по-голям риск от Даунова бременност. Затова във Великобритания ефикасността на програмата за тестване се определя спрямо очаквания брой Даунови бебета, като се има предвид възрастта на майките, които ще раждат през съответната година. Ние сме свидетели на непрекъснато намаляваща пропорция на раждащи се бебета със синдром на Даун; през 1994 година например, програмите за пренатален скрининг намалиха случаите на раждане на бебета със синдром на Даун с около 40%.
Тризомия може да се появи и при други хромозоми, но в такъв случай аномалиите са толкова тежки, че се стига до спонтанно абортиране на плода във всички случаи, освен при тризомии на хромозоми 13 и 18. Но бебетата с тризомия 13 рядко живеят повече от няколко седмици след раждането, а децата с тризомия 18 обикновено умират преди да навършат една годинка. Хромозомните аномалии, в това число и тризомията, вероятно са доста разпространени. И докато много от тях са смъртоносни — смята се, че около 30% от зачеванията завършват със спонтанен аборт и при половината от тях се наблюдава някаква форма на хромозомно отклонение — други не се отразяват по никакъв или почти по никакъв начин. Възможно е промените да бъдат далеч не така драматични като загубата или добавката на цяла хромозома и да включват пренареждане на участъци в дадена хромозома или пренасяне на част от едната хромозома в другата. При загуба или добавка на генетичен материал, какъвто е случаят с появата на цяла допълнителна хромозома, се стига до вредно нарушаване на равновесието. За жалост, стандартният цитологичен анализ на хромозомите на зародиша, е в състояние да установи наличието само на значителен дисбаланс, но понякога и нарушеното в по-малка степен равновесие може да доведе до катастрофални последици.
След като прави опит да забременее за първи път на трийсет и седемгодишна възраст, Катлин Маколиф научава с облекчение, че след направената й амниоцентеза е установено наличието на само две хромозоми 21. Тя обаче няма представа, че тестът може да разкрие и други хромозомни аномалии. Цитогенетикът установява инверсия на хромозома 2 на плода: все едно даденият участък е бил отделен, тръснат и вкаран отново, но обратно. Информацията не е придружена от полезен съвет: съществува вероятност инверсията да създаде проблем, например възникване на генетичен дисбаланс, но е възможно и да не се случи нищо особено. Единият начин да се разбере нещо повече е като се погледне втората хромозома на Маколиф и нейния съпруг. Ако някой от родителите притежава инверсията (тоест ако не става въпрос за спонтанна промяна в тяхното дете), може да се предположи, че тя не влияе, тъй като и двамата родители са нормални. Но нито Маколиф, нито нейният съпруг имат преобърната хромозома 2, което навежда на мисълта, че това е нещо ново, станало в сперматозоида или яйцеклетката. Какво ще причини на бебето тази инверсия? Внезапно Маколиф се оказва пред вземането на решение на живот и смърт. След непоносима агония тя решава, че несигурността е прекалено голяма и прекратява бременността. Въпреки изричната молба да не бъде информирана за резултатите от аутопсията — тя е достатъчно тъжна и разяждана от чувство за вина заради загубата на плода — в резултат на административна грешка докладът е изпратен на домашния й адрес и тя разбира, че плодът действително е бил сериозно увреден. Това обаче е слаба утеха и Маколиф все още пази ултразвуковата снимка на своето неродено бебе, скрита в едно чекмедже. За щастие, при следващите бременности не се наблюдават подобни усложнения и сега Маколиф е благословена с две малки деца в превъзходно здраве, както се изразява тя самата.
Генетичните знания пораждат етични дилеми. Маколиф не е била предупредена, че амниоцентезата може да установи наличието и на други проблеми, а не само на тризомия 21; може би цитогенетикът е престъпил границите на професионалната етика, като не е докладвал само резултатите от поръчания тест. Разбира се, избор нямаше да има, ако беше използван метод, разкриващ единствено броя на хромозома 21. Тъй като става все по-съвършен, генетичният скрининг се превръща в нещо като кутията на Пандора; неговите последствия надхвърлят значително първоначалната мотивация на теста и понякога се отразяват върху живота не само на тестваните хора. Това е особено очевидно при генетичното тестване на семейства, в които вече има засегнати от вродени заболявания като мускулната дистрофия на Дюшен, болестта на Хънтингтън или кистозната фиброза. В тези случаи диагностицирането се извършва не от цитогенетик, а от молекулярен биолог, който анализира конкретни отрязъци ДНК, а не части от хромозоми. ДНК се извлича от тъканната проба, взета от плода чрез амниоцентеза, или от дете или възрастен човек чрез вземане на кръв или клетки от лигавицата на устата с шпатулка. Днес тестът обикновено включва умножаване на критичния участък от пробата с ДНК — заподозрения ген — чрез полимеразна верижна реакция, последвана от секвенционен анализ, за да се определи дали носи въпросната мутация. И резултатите от теста за даден човек могат да ни дадат известна информация за генетичния статус на неговите роднини.
Да вземем например тестването за болестта на Хънтингтън. Неотдавна мъж на двайсет и няколко години отива в клиника, за да бъде тестван за болестта на Хънтингтън. Дядо му по бащина линия е починал от тази болест, а баща му, на четирийсет и няколко години, подобно на Нанси Уекслър, решава да не се изследва, предпочитайки да живее с несигурността 50:50. Тъй като болестта на Хънтингтън поразява сравнително късно, напълно е възможно бащата да носи мутацията, макар симптомите все още да не са се появили. Младият мъж знае, че вероятността да носи мутацията — и следователно да бъде поразен от болестта в даден момент от живота си — е 1:4.[4] Но иска да бъде сигурен. Проблемът е следният: ако се окаже, че действително носи тази мутация, значи трябва да я е наследил от баща си и при баща му също в крайна сметка ще се прояви болестта на Хънтингтън. Желанието на сина да се информира е абсолютно несъвместимо с желанието на бащата да не научи истината. Възникват семейни препирни и в крайна сметка единствено намесата на майката спира сина от правенето на теста. Тя настоява, че желанието на младежа да знае определено бледнее пред правото на баща му да бъде предпазен от нещо, което може да се окаже опустошителна смъртна присъда. Този драматичен пример илюстрира разликата между генетичното диагностициране и другите видове диагностициране. Това, което мога да науча за моите гени, ще се отрази и върху биологичните ми роднини, независимо дали искат да имат подобна информация.
Понякога изводите може да не се отнасят за сегашното, а за бъдещите поколения. Чупливата X хромозома е най-разпространената форма на наследено забавено умствено развитие. (Синдромът на Даун е по-често явление, но обикновено не е наследствен, защото се появява спонтанно.) Освен ниския коефициент на интелигентност, типичните симптоми включват впечатляващо издължено лице с непропорционални по размери уши и челюсти и хиперактивен, понякога придружен от раздразнителност темперамент. Подобно на мускулната дистрофия на Дюшен, болестта е свързана с пола (отговорният ген е в X хромозомата), но, за разлика от мускулната дистрофия на Дюшен, засяга както мъже, така и жени. Наличието на едно нормално копие на гена очевидно не е достатъчно, за да се справи с въздействието на мутиралото; все пак симптомите при жените обикновено не са толкова силни и при тях честотата е 1:8 300, докато при мъжете е 1: 5 000. Чупливата X хромозома се причинява от мутация, подобна на отговорната за болестта на Хънтингтън: една ДНК тройка, ЦГГ, се повтаря многократно. При нормалните индивиди повторенията са около 30, докато носителите на чупливата X хромозома имат поне 50, а понякога до 90. Поради причини, които не са ни напълно ясни, броят на повторенията обикновено нараства с всяко следващо поколение; и когато тройките ЦГГ станат около 230, генът не е в състояние да произвежда повече съобщителна РНК и в резултат престава да функционира. Състоянието получава името си от характерна структурна слабост в X хромозомата, причинена от всички тези повторения.
С увеличаване броя на повторенията с всяко следващо поколение, състоянието става все по-тежко, а възрастта на появата намалява във всяко фамилно дърво. Последните наследници на семействата с чуплива X хромозома имат най-голям брой повторения и обикновено са засегнати в по-ранен етап на живота си и по-тежко от тези, от които са наследили мутацията. Следователно, генетиците могат да идентифицират носителите на „премутация“ — прекалено малко повторения, за да причинят проблеми в момента, но достатъчно, за да доведат до чуплива X хромозома в следващите поколения, като се има предвид тенденцията за нарастване на броя им. Все още не знаем точно какво прави произвежданият от засегнатия ген протеин, но по всичко изглежда, че свързва молекулите съобщителна РНК в свръзките — синапси — между нервните клетки.
Подобно на изследванията на болестта на Хънтингтън, мускулната дистрофия на Дюшен и много други наследствени заболявания, изследванията на чупливата X хромозома са катализирани от най-пряко засегнатите: семействата и любимите хора на страдащите. Асоциация „Чуплива X хромозома“ с голям успех събира средства и убеждава Конгреса да подкрепя изследванията на чупливата X хромозома. Макар някои учени да гледат цинично на подобни групи като на агенции, създаващи сред намиращите се в трудно положение хора усещането, че не са напълно безпомощни, опитът показва друго: посветилите се на своето дело, находчиви и преди всичко — мотивирани организации като Асоциация „Чуплива X хромозома“, понякога действително държат ключа към справянето с подобни заболявания. Тези, които поемат най-голям риск, както финансов, така и научен, понякога, при късмет, биват и най-щедро възнаградени.
Много от четящите тези редове жени може би си задават въпроса: „А защо по време на бременността ми не ме тестваха за кистозна фиброза, чуплива X хромозома или мускулна дистрофия на Дюшен?“ Най-тъжното е, че някои от тях може дори да имат деца с някое от споменатите заболявания. На фона на генетичната революция, трансформирала медицинската технология, ставаме свидетели на депресиращ и безсмислен факт: липсата на съчетаване между научния прогрес и грижите за пациентите. Може би е по-точно да се каже, че никога не е обръщано нужното внимание на правилното им съчетаване. Много жени просто не са информирани за различните възможности и вече съвсем достъпните тестове се използват изключително малко.
Като ръководител на Проекта за изследване на човешкия геном, аз се погрижих за финансирането на усилията, подпомагащи разбирането как знанието, което скоро щеше да се излее от секвенционните машини, ще се отрази, за добро или лошо, върху живота на безброй много хора. След като отделих първоначално 3% от общия бюджет (и по-късно — 5%) за тази цел, аз назначих Нанси Уекслър — специалист по болестта на Хънтингтън — да оглави експертната група, наречена „ЕЮСЕ“, натоварена да изследва етичния, юридическия и социалния ефект от нашите проучвания. Една от главните инициативи на ЕЮСЕ беше поредицата от пилотни изследвания на генетични тестове. По времето, когато всяко новородено се подлагаше на скрининг за ФКУ, беше необходимо да се запитаме дали медицината би могла отговорно да не предложи поне възможност за тест за кистозна фиброза, мускулна дистрофия на Дюшен, чуплива X хромозома и всички други тежки човешки болести, които можеше да предскаже науката. Беше началото на деветдесетте години на XX век. Днес положението не е много по-напреднало от пилотния стадий: все още тук-там се провеждат изследвания в малък мащаб. Причините за тази парализа са различни, вариращи от материалната практичност до дълбоките философски несъгласия за същината на човешкия живот и достойнство. Накратко, те обхващат цялата гама от социални феномени — от жонглирането за набиране на средства до колективното изследване на душата — съпровождащи генетичната революция.
Тестването за мускулна дистрофия на Дюшен и болест на Хънтингтън се прави обикновено в семействата, в които вече има един засегнат член. Съображенията за подобно ограничение са, че заболяванията са редки, а тестовете — скъпи. Тези изводи са спорни, но не са в сила в случая с кистозната фиброза, тестването за която обаче е също ограничено. Да си припомним, кистозната фиброза засяга 1 на 2 500 човека, което я прави едно от най-разпространените генетични заболявания, особено сред хората със северноевропейско потекло. Високият процент изглежда още по-забележителен, като се има предвид, че причиняващият го дефект, който се появява в ген в хромозома 7, следва рецесивен модел на наследяване; това означава, че за да развие кистозна фиброза, човек трябва да наследи две мутирали копия. Хората само с едно мутирало копие не са засегнати, но като носители, могат да предадат мутацията на своите деца. Епидемиологичните изследвания и изчисления показват, че 1 от всеки 25 американци с европейски произход, е носител на мутацията.
Една от трудностите, свързани с тестването на кистозната фиброза, е техническо, и е свързано с варирането на лежащия в основата й дефект. Една специфична форма на мутацията е отговорна за около 70% от случаите: заличаване, наречено ∆-F508, в резултат на което липсват три бази: ЦТТ.[5] Ако останалите 30% се дължаха само на няколко други мутации, тогава подлагането на населението като цяло на скрининг за кистозна фиброза не би било непрактично. Но повечето от другите мутации причинители са характерни само за една фамилна линия и досега са открити повече от хиляда различни мутации, причиняващи кистозна фиброза. Какво означава това за тестването на населението? Всеки тест може да проверява най-много за двайсет и пет различни мутации, но тези двайсет и пет най-разпространени форми ще бъдат отговорни само за 85% от случаите. В резултат ще пропускаме по една на всеки шест мутации… определено не особено надеждно диагностициране. Да предположим, че някоя двойка получава негативни резултати от скрининга за кистозно-фиброзни мутации според нашия изключително несъвършен тест. При това положение не бихме могли да ги уверим, че няма опасност да създадат дете с кистозна фиброза. „Защо тогава да си правим труда да извършваме изследвания за 300 $, след като дават толкова неубедителни резултати?“ — питат опонентите.
Но, въпреки техническите трудности, пренаталният скрининг за кистозна фиброза все пак е в състояние да идентифицира голяма част от засегнатите зародиши. Защо тогава не се прилага по-широко? Парадоксално, но членовете на организациите, свързани с кистозната фиброза, изиграха важна роля за ограничаване тестването за тази болест до вече засегнатите семейства. Те се опасяват, че по-широкото приложение ще отклони и без това ограничените средства от най-важната цел — откриване на лекарство. Притеснението е разбираемо, особено в този момент. Смята се, че трийсет хиляди американци имат кистозна фиброза. Напредъкът в третирането вече е увеличил значително средната продължителност на живота им и се предполага, че не след дълго ще бъде намерено лекарство. Но би било безотговорно да се твърди, че това ще стане всеки момент: бебетата, родени днес с кистозна фиброза, все още са изправени пред перспективата цял живот да се борят с омаломощаваща болест. Макар лечението на кистозна фиброза несъмнено да е главният приоритет, все пак бременната жена би трябвало да има възможност, при желание, да се тества. И тогава, вече информирана за състоянието на плода, тя ще има свободата да направи своя избор.
Съпротивата срещу по-масовото тестване има и други, не толкова материални причини. Някои гледат на скрининга като на признание за поражение, на неправилното решение. Създават се групи специално с цел да помогнат на хората с дадено заболяване да чувстват, че принадлежат към някаква общност и обществото ги цени; но как може тази мисия да се съчетае с тестването, което насърчава абортирането на увредените зародиши?
Сдруженията „Кистозна фиброза“ например се притесняват да не би страдащите от заболяването хора да бъдат белязани по такъв начин и се опасяват, че тестването прави именно това, макар и индиректно. В историята на генетичното тестване съществува нещастен прецедент, който преследва всички подобни групи. Много преди появата на ДНК скрининга, е разработено едно от първите диагностицирания за вродени болести, а именно — за установяване на сърповидно-клетъчната анемия, която в Съединените щати поразява предимно американците с африкански произход. Както видяхме в Трета глава, хората, наследили две мутирали „сърповидни“ копия на гена на хемоглобина, страдат от мъчителни, омаломощаващи симптоми, докато при носителите само на едно копие те почти не се проявяват.
След разработването на лесни начини за кръвни изследвания през шейсетте години на XX век, из цялата страна набързо се създават програми за скрининг. Въпреки добрите намерения, те причиняват повече вреда, отколкото полза. Тестващите обикновено не обясняват както трябва на тестваните какви са целите или резултатите от изследването. Мнозина от диагностицираните като носители заключават погрешно, че са болни; на някои се отказват дори работа или здравни осигуровки въз основа на изследването; а изложените на риск от създаване на деца със сърповидно-клетъчна анемия двойки са съветвани доста грубо да помислят дали изобщо да стават родители. Тестовете — някои програми са задължителни — са всъщност насилствени и създават у някои впечатлението за възраждане на расистката евгеника, защото белязват хората, получили положителен резултат. Тъжната ирония във всичко е, че от чисто медицинска гледна точка, кампанията е замислена съвсем разумно: въпреки напредъка в лечението, сърповидно-клетъчната анемия си остава хронично, мъчително заболяване. Тестването е най-доброто лекарство за болест, която е много по-лесно да избегнеш, отколкото да се справиш с нея, но първите механизми, замислени с цел нейното изкореняване, се осъществяват толкова зле, че по-скоро разгневяват хората, на които би трябвало да помогнат.
За щастие, през 1972 година новите насоки на правителството преработват програмата за скрининг на сърповидно-клетъчната анемия и й позволяват да докаже ефективността си, без да поражда притеснения като първоначалните усилия в тази област. По-трудно е да се възстанови доверието на групите, работещи в подкрепа на страдащите от различни генетични заболявания; опитът им от случилото се с болните от сърповидно-клетъчна анемия ги кара да се отнасят с недоверие към програмите за тестване, а страхът от белязване остава, понякога, уви, за сметка на подобряване на общественото здраве.
В много отношения, въпреки несъмнената си полза, генетичното тестване предизвиква много спорове. Ранди Хейгърман, по това време в Детската болница в Денвър, решава да приложи ДНК тест за чуплива X хромозома при децата, обучавани в специалните класове на Денвър. Логиката е проста: за децата, чиито способности да учат са намалени от това заболяване, ще бъде най-добре да се открие точната причина, за да може обучението им да се пригоди конкретно според техните специфични нужди. Оказва се, че от изследваните 439 деца, 5 са с чуплива X хромозома. (По-обхватно изследване в училища в Холандия открива 11 неустановени преди това случаи на чуплива X хромозома в група от 1 531 ученици.)
Може би най-интересното в Денвърското изследване е реакцията на родителите и настойниците на предложението на Хейгърман. Повечето са съгласни, че диагностицирането ще бъде от полза, както заради потенциала обучението на детето им да се подобри, така и защото ще идентифицира наличието на тази болест в семейството. Една трета обаче се отказват от теста, изказвайки или убедеността си, че детето им няма чуплива X хромозома, или опасението, че тестът може да стресира детето. Хейгърман получава критики за своите усилия; те обединяват тези, които виждат заплаха от тоталитарно генетично бъдеще във всеки опит за вземане на ДНК с цел справяне с някакъв социален проблем.
А въпросът действително е колкото личен, толкова и социален. Високият процент премутации на чупливата X хромозома — може би при 1 от всеки 200 X хромозоми — вероятно е основателна причина за масов скрининг на населението. Смята се, че само един сериозен случай, като се включва невъзможността на засегнатия да работи и институционализирането му, ще струва в Съединените щати около 2 000 000 $. Непрестанно нарастващото предизвикателство за осигуряване на достъпни здравни грижи, е достатъчно убедителен аргумент в защита на осигуряването на възможност на всяка майка да бъде тествана. Тази логика не убягва и на по-малките страни, където възможностите за политически грешки са още по-малки. Едно пилотно изследване в Израел подлага на скрининг 14 334 жени; установява се, че 207 от тях имат премутация. Пренаталното диагностициране е достъпно по желание и така са идентифицирани пет зародиша с увеличен брой повторения ЦГГ. Определянето на съдбата на всяка една от тези бременности по право се полага на майката: едно свободно общество не би трябвало да изисква от нея да направи аборт или да износи до края плод с открито генетично заболяване. Но не всяка жена е готова да гледа дете инвалид, така както не всяка жена е готова да прекъсне бременността си, заради предвижданото качество на живот на носеното от нея дете. Независимо от личния избор обаче, остава фактът, че скринингът може само да намали случаите на подобни заболявания, а това несъмнено е за благото на цялото общество.
Въпреки отчайващата неохота да се възползваме от предимствата, които ни предлага широкомащабният генетичен скрининг, кратката история на практиката не се състои само от пилотни изследвания в малък мащаб и осъдителни полемики. Има и щастливи и поучителни истории, разказващи за триумфа на програмите за тестване за генетични болести в изложените на по-голям риск популации.
Хемоглобинопатиите са болести, причинени от неправилно функциониране в молекулата на хемоглобина, в това число различните таласемии и сърповидно-клетъчната анемия. Смята се, че са най-разпространеният клас вродени заболявания, като около 4,5% от населението носи мутация на някое от тях. Както видяхме, генът на сърповидно-клетъчната анемия има противомаларични свойства и затова създаването му се поощрява от естествения подбор в регионите, където маларията се среща често. В резултат, първоначално мутацията се среща често само в тези части на света. Същото адаптивно предимство е отговорно и за разпространението и на другите хемоглобинопатии. Медицината постепенно достига до извода, че дадени мутации са по-разпространени сред определени етнически групи, независимо къде живеят сега отделните индивиди.
Сред популацията на кипърските гърци в Лондон, носителите на таласемията са цели 17%. В тежката си форма заболяването е най-вредната хемоглобинопатия и се изразява в безформени и, понякога, снабдени с ядра червени кръвни телца, които причиняват увеличаване на черния дроб и далака; то често завършва със смърт още преди достигането на зрелост. Системната програма за скрининг, стартирана през 1974 година от Бърнадет Модъл от Кралското медицинско училище, е посрещната ентусиазирано от кипърските гърци в Лондон, които си дават много добре сметка за сериозността на поразяващата отдавна общността им болест. Стартирането на подобна програма в Сардиния, пак през 1974 година, намалява забележимо случаите на таласемия от 1:250 до 1:4 000.
Ешкеназките евреи са друга група, която си дава горчива равносметка какво може да причини смъртоносната мутация на една генетично изолирана популация. Ужасната болест на Тей-Сакс е сто пъти по-разпространена сред тази група, отколкото сред повечето нееврейски групи. Засегнатите от нея бебета се раждат видимо здрави, но развитието им постепенно се забавя и те започват да ослепяват. Около втората им година се появяват припадъците. Влошаването на състоянието им продължава, докато умрат, обикновено на около четиригодишна възраст, слепи и парализирани. За разлика от хемоглобинопатиите, чието относително по-широко разпространение сред дадени популации обикновено може да се обясни със съпътстващата адаптивна протекция срещу малария, си остава загадка защо болестта на Тей-Сакс се среща по-често сред ашкеназите. Може би причината е генетично стеснение: възможно е мутацията да е присъствала сред сравнително малката група, която се отделя, за да се превърне в ашкеназите по време на втората диаспора. Може би подобен феномен обяснява и защо мутацията е толкова разпространена сред френските канадци от Югозападен Квебек, както и сред кейджъните в Луизиана: случайното присъствие на нещастна мутация в малката популация на основателите на двете колонии. Според едно от алтернативните обяснения носителят на този рецесивен ген (на едно копие от мутацията на болестта на Тей-Сакс) има по-голяма резистентност срещу туберкулозата и това може би е било предимство за европейските евреи, които са обитавали в повечето случаи гъсто населените градски центрове.
Причината за болестта на Тей-Сакс е открита през 1968 година; тогава е установено, че червените кръвни телца на пациентите са претоварени с ганглиозида GM2. Този химикал е важен компонент на клетъчната мембрана и при нормалните индивиди излишъците от него се разлагат до други съединения от един ключов ензим, който липсва при страдащите от болестта на Тей-Сакс. През 1985 година Рейчъл Майеровиц и нейните колеги от Националните здравни институции изолират гена, кодиращ въпросния ензим, и показват, че той действително е мутирал при пациентите с болестта на Тей-Сакс.
Сега вече се разполага с база за сигурен пренатален тест и добре дефинирана целева популация; това са като че ли създадени по поръчка условия за успешна програма за скрининг. Но пренаталният скрининг всъщност предлага само един лек при положителна диагноза: аборт, който, поне сред ортодоксалните ашкенази, е забранен. За щастие е възможно също така да се тестват потенциалните родители и така, морално приемливото решение за вярващите хора е програмата, насочена към двойките. Рави Йозеф Екщайн вижда как четири от десетте му деца умират от болестта на Тей-Сакс. През 1985 година той създава Дор Йешорим, „поколение на праведните“, програма за осъществяване на тестване за болестта на Тей-Сакс сред местната ортодоксална еврейска общност. Младите хора са насърчавани да се възползват от възможността за безплатно тестване, която се дава в гимназията и университета. Необичаен аспект на тази програма е изключителната поверителност: дори тестваните не са информирани дали са носители; вместо това всеки получава кодов номер. По-късно, когато двама млади решат да се оженят, всеки от тях се обажда в Дор Йешорим и си дава номера. Състоянието им се разкрива само ако и двамата са носители, заедно с предложението за помощ от психиатър. Целта на това разкриване само когато е наистина необходимо, е да се избегне белязването на носителите и същевременно да се направи всичко възможно за предотвратяване на заплахата от създаване на деца с болестта на Тей-Сакс.
До този момент програмата Дор Йешорим е тествала над седемдесет хиляди човека и идентифицирала повече от сто рискови двойки. Тя намалява значително случаите на болестта на Тей-Сакс и очевидно се радва на успех, но някои от членовете на еврейската общност виждат недостатъци в нея. Според едни тя принуждава всички млади хора да се тестват и ги сплашва със сериозната си препоръка носителите сред тях да преразгледат решението си да се оженят. Опоненти кръщават програмата на рави Екщайн „евгеника“ (дума, която резонира особено болезнено именно сред еврейската общност), но подобна демагогия не променя главния факт на въпроса: програмата очевидно се радва на силна подкрепа сред общността, която обслужва, общност, която е наясно с ужасите на болестта на Тей-Сакс. Дор Йешорим демонстрира практически, че програмата за скрининг може да бъде едновременно ефективна и съобразена с дадената култура, и да върши работа дори в ситуация, при която обществените нрави и религиозни принципи на пръв поглед са несъвместими с генетичното тестване по принцип.
Пренаталният скрининг предлага избор само между две възможности за жената, носеща плод с установено генетично заболяване: да прекрати или да износи докрай бременността. Фактът, че амниоцентезата не може да се направи преди зародишът да навърши поне петнадесетата седмица, прави избора на аборт още по-травмиращ. На този стадий абортът не отстранява безформена топка от клетки, а миниатюрно същество, достатъчно реално, за да е създало вече връзка с родителите благодарение на силата на ултразвуковия образ. Повечето родители, поне тези, които не са против всички аборти по принцип, биха предпочели да бъдат изправени пред този невероятно труден избор, поставен от генетичното тестване, поне в един по-ранен стадий на бременността. Точно такава е и идеята при създаването на предимплантационното диагностициране.
Робърт Уинстън от болницата „Хамърсмит“ в Лондон е водещ гинеколог микрохирург, специалист в процедури като коригиране на дефекти на фалопиевите тръби, които пречат на жената да зачене. Той се превръща също така в един от водещите английски телевизионни популяризатори на научните и биомедицинските изследвания и дори намира време, като лорд Уинстън от „Хамърсмит“, за парламента, за да съветва правителството по тези въпроси. Като съчетава две съвременни технологии — оплождането ин витро и ДНК диагностицирането на базата на полимеразната верижна реакция — Уинстън става пионер в метод за проверка на генетичния статус на ембриона, преди да бъде имплантиран в матката на жената и да започне да се развива. След оплождането ин витро, няколкото оплодени яйцеклетки се отглеждат в лабораторията, докато се разделят три-четири пъти, за да произведат топчица от осем или шестнайсет клетки. Тогава от всяка от тях се отделят внимателно една-две клетки, за да бъде извлечена ДНК, после, с помощта на полимеразната верижна реакция се умножават съответните последователности, за да се определи във всеки случай наличието или липсата на мутация. Този метод на свръхранно диагностициране е възможен единствено благодарение на способността на полимеразната верижна реакция да умножава дори най-малки количества ДНК. След това родителите могат да имплантират само ембрионите с отрицателен тест за генетични болести.
Първите предимплантационни тестове се правят през 1989 година за определяне пола на зародиша, важна информация, когато рискът е свързан с болест, засягаща представителите само на единия пол, като мускулната дистрофия на Дюшен. Майката носител може да избере само женските ембриони, защото те няма да бъдат засегнати, макар и да е възможно да бъдат носители. Именно колегата на Уинстън, Алън Хендисайд, и други впоследствие разширяват предимплантационното диагностициране, така че да идентифицира конкретни мутации: през 1992 година те прилагат за първи път техниката за тестване за кистозна фиброза, която не е свързана с пола.
Както видяхме, макар да е свързана с пола, чупливата X хромозома засяга както мъжете, така и жените. Следователно тази болест е естествена мишена за предимплантационното диагностициране, но въпреки това беше нужна намесата на родители, запознати с трудностите около отглеждането на дете с чуплива X хромозома, за да мобилизират лекарите да го правят. Деби Стивънсън, телевизионен репортер на Си Ен Би Си, има син Тейлър, чиято чуплива X хромозома бе диагностициран едва след раждането на втория син, Джеймс. Макар Джеймс, за щастие, да изтегля печелившата карта от вероятността 50:50 да наследи болестта, семейство Стивънсън няма желание да повери и третото си дете на съдбата. Те решават да се обърнат към предимплантационното диагностициране: „Някои смятат, че е неетично да се избират здрави ембриони — споделя Деби Стивънсън, — но аз мисля, че е за предпочитане пред ужасния избор дали да прекъснеш бременността си или да я изкараш докрай, след като разбереш, че бебето ти страда от сериозна болест.“ През 2000 година, след отчайващите едногодишни издирвания на лаборатория, готова да извърши процедурата, най-младият член на семейство Стивънсън е заченат и, само дни по-късно, тестван за чуплива X хромозома. Също като Джеймс, Саманта не е засегната от въпросното заболяване.
 Семейството на Деби Стивънсън. Най-голямото момче Тейлър има чуплива X хромозома. Предимплантационното диагностициране подсигури Саманта, бебето, да бъде без чуплива X хромозома.
Семейството на Деби Стивънсън. Най-голямото момче Тейлър има чуплива X хромозома. Предимплантационното диагностициране подсигури Саманта, бебето, да бъде без чуплива X хромозома.
В нашата култура човешката репродуктивна биология изглежда е неизчерпаем източник на противоречия, и процедурата, свързана с манипулирането на човешки ембриони с каквато и да било цел, няма как да не се превърне в гръмоотвод. Предимплантационното диагностициране не прави изключение. Но, дори без да говорим за етичните съображения, процедурата има два големи недостатъка: изисква огромно отдаване от страна на предприелата го двойка и, като всички форми оплождане ин витро, е много скъпа. Но методът е толкова мощен по принцип и толкова по-малко травмиращ от аборта, че можем само да се надяваме след време да станем свидетели на използването на още по-добри техники и наред с това намалена цена — обичайният модел на развитие на всяка нова технология. Предимплантационното диагностициране има потенциал да се превърне в изключително важно оръжие в борбата ни с генетичните заболявания.
Всички обсъждани досега болести са „прости“ в генетично отношение: причиняват се от мутации в един ген и околната среда не влияе върху това дали даден индивид ще получи или няма да получи въпросния ген. Положението е доста по-сложно при болести като рак; както видяхме, той може да се причини от комбинация от наследствени фактори и влиянието на обкръжението. Но дори при рака, съществуват индивидуални гени, оказващи много силно въздействие независимо от средата. Макар BRCA1, един от гените, свързани с рака на гърдата, да е отговорен само за около 5% от всички случаи, вероятността жените с мутация в гена да се разболеят до шейсетата си година е 90%.
В началото на деветдесетте години Франсис Колинс, по това време в Мичиганския университет, обединява силите си с Мери-Клер Кинг от Калифорнийския университет в Бъркли в лова на BRCA1. Те избират стандартния подход: събират семейства, подготвят ДНК проби и тестват маркерите, с надеждата да попаднат на гена. В едно семейство с повече от петдесет члена има много случаи на рак на гърдата — ясен пример за наследено предразположение към заболяването. През септември 1992 година член на това семейство — ще я нарека „Ан“, разкрива пред една от сътрудничките на Колинс, Барбара Уебър, че за следващата седмица е уговорила билатерална мастектомия, макар засега да няма признаци за рак на гърдата. Ан решава, че не е в състояние да понася повече несигурността, надвисналата над бъдещето й въпросителна, и решава да предприеме тази драстична стъпка. Уебър обаче заключава от ДНК анализа, че Ан не е изложена на особена опасност: рискът да заболее от рак на гърдата при нея не е по-голям, отколкото при жена без подобна семейна история. Но заключението е направено в контекста на изследователски проект, а много преди това е прието правилото предварително получената информация да не се използва за клинично диагностициране.
Уебър и Колинс обаче решават, че дилемата на Ан надделява над правилото: те я информират, че рискът й е малък и тя се отказва с огромно облекчение от операцията. Но след като споделят своите открития с един член на семейството, учените се чувстват задължени да предложат същото и на другите членове, които ги помолят; и така Уебър и Колинс създават извънредна програма за генетични препоръки при рак на гърдата. Една от членовете на семейството, която също се оказва, че не е изложена по-висок от средностатистическия риск, се е подложила на профилактична билатерална мастектомия преди пет години. Тя приема философски информацията: операцията все пак й донася пет години спокойствие. Но ако тестът за мутацията се бе оказал позитивен, радикалната стъпка може би щеше да й е осигурила нещо повече от спокойствие. От години профилактичната мастектомия се препоръчва от лекарите, макар да бе неосъществимо оперативната намеса да отстрани цялата тъкан на гърдите и да нямаше солидни доказателства, че тази мярка е спасила нечий живот. Днес обаче съществуват доказателства, че тази крайна мярка действително намалява смъртността сред изложените на по-висок риск жени; в една група от 639 жени само 2 (вместо 20–40 от очакваните в резултат на статистическите данни) умират от рак на гърдата. По подобен начин, отстраняването на яйчниците преди четирийсетгодишна възраст намалява риска от рак на яйчниците и на гърдата. Генетичният анализ може да даде на жените властта да вземат решения буквално на живот и смърт.
Но все още доста ограниченият ни поглед към бъдещите промени, до които ще доведе анализът на ДНК, позволява да смятаме, че ще се увеличат възможностите ни да се справяме с рака на гърдата и с не толкова крайни мерки, както разкрива друго изследване от Мичиган. На една от братовчедките на Ан казали, че най-вероятно носи мутацията BRCA1, унищожаваща семейството им. Тъй като не си е правила мамограма от години, дължащо се на страха пренебрежение, често срещано в рисковите семейства, тя изпада в паника. Уебър назначава мамография за същия ден и е открит миниатюрен зараждащ се тумор. Отделен е с лекота, но със сигурност щеше да бъде пропуснат при един рутинен преглед. Самонаблюдението с опипване на млечните жлези и редовните мамографии несъмнено са спасили не един живот, но кампанията за универсализиране на тези процедури води до един непредвиден ефект — създаване на фалшиво усещане за сигурност в някои случаи. Скринингът за генетичен риск ни позволява да откриваме хората, чиито прегледи чрез някакви образи трябва да бъдат особено обстойни. По-големият риск изисква по-голяма бдителност. И в крайна сметка, колкото по-малка бъде купата сено, толкова повече игли ще бъдат намерени.
Нанси Уекслър, като член на семейство с много случаи на болестта на Хънтингтън, и Ан, като член на семейство с много случаи на рак на гърдата, са част от ново поколение, което може да добие представа за очакващата го генетична съдба чрез тестовете за генетичен скрининг, с които разполагаме отскоро. И колкото повече научаваме за генетичната основа на относително разпространени заболявания, от диабет до сърдечни болести, толкова по-мощна ще става кристалната топка и ще разкрива генетичното бъдеще за все повече хора.
През последното десетилетие малко болести изпълниха с ужас толкова много сърца, колкото болестта на Алцхаймер, която всяка следваща година поразява все по-голям брой хора, причинявайки физическа и умствена немощ; тя е застигнала вече повече от 4 000 000 американци. Роднините и приятелите на страдащите в началото може да забележат някои незначителни пропуски в паметта, например трудно припомняне на скорошни събития или намиране на нужната дума, и обикновено ги приписват на напредващата възраст. След това е възможно в засегнатия да се проявят чести промени в настроението, което също не е необичайно сред възрастните хора. Но с напредването на болестта симптомите стават по-изразени и вече не могат да се сбъркат; загубата на паметта скоро става неестествено силна, до такава степен, че познатите предизвикателства на работното място или дори простите домакински задължения се превръщат в непреодолими бариери. Говорът се затруднява все повече; изреченията остават недовършени, защото жертвата губи нишката на мисълта си. А осъзнаването на този факт може да причини депресия, която на свой ред задълбочава ефекта от другите, все по-стресиращи промени на личността. Пациентите в напреднал стадий на болестта на Алцхаймер не знаят кои са или къде се намират, не могат да разпознаят даже най-близките си хора. С неумолимата ерозия на тяхната памет и личност, постепенно се разрушава самата им същина като индивиди.
В типичния случай тази болест се появява около шейсетата година, но една по-рядка форма, обхващаща около 5% от всички случаи, поразява хора на четирийсет-четирийсет и няколко години. Тази ранно появяваща се форма подлага семействата на същия ад, както и болестта на Хънтингтън, като поразява жертвите си в разцвета на живота им и постепенно и неумолимо ги разрушава. Едно семейство, от което бяха поразени много членове в продължение на няколко поколения, описва това страдание като поразяване от своя собствен „биологичен Холокост“. Следвайки довода, представен за първи път от Мери-Клер Кинг при изследванията й на рака на гърдата, че е по-вероятно по-ранните прояви на дадено заболяване да имат генетична основа, повечето първоначални изследвания на болестта на Алцхаймер се насочват именно към по-рано проявяващата се форма. До 1995 година са открити три гена, свързани по някакъв начин с отлагането на протеина амилоид; неговото натрупване в главния мозък на пациентите е забелязано още през 1906 година и е включено към първото описание на болестта, направено от доктор Алойс Алцхаймер. Следователно ранните случаи на заболяване от това страдание са с ясен наследствен характер. А какво тогава е положението с по-късните прояви на болестта?
Алън Роузис от Университета на Дюк предпочита да не се съобрази с мнението на мнозинството и се заема с много по-познатата късна форма, която само в редки случаи се среща многократно в дадено семейство. Роналд Рейгън например, който обяви, че е засегнат от това заболяване през 1994 година, две години по-късно загубва брат си Нийл пак в резултат на късната му форма. Майка им също умира от него.
Въоръжен с опита си като невролог и основно запознат с мускулни заболявания като мускулната дистрофия на Дюшен, Роузис започва своето изследване през 1984 година. А твърдението му от 1990 година, че болестта на Алцхаймер изглежда е свързана с един ген от хромозома 19, е посрещнато със скептицизъм. Той обаче успява да докаже на всички, че грешат. Две години по-късно Роузис идентифицира въпросния ген. Оказва се, че кодира аполипопротеин E (APOE), свързан с преработката на холестерола. Генът се среща в три форми (алели): APOEε2, APOEε3 и APOEε4, като проблемният се оказва APOEε4 — само едно негово копие увеличава четирикратно риска на неговия носител да развие болестта на Алцхаймер. А човекът с две копия е десетократно по-заплашен от болестта отколкото човека без алел APOEε4. Роузис открива, че 55% от хората с две копия APOEε4 се разболяват до осемдесетата си година. Възможно ли е откриването на тази връзка да стане основа за генетичен тест? Вероятно не. APOEε4 е действително свързан с тази болест, но е доста разпространен и не е достатъчно добър неин предизвестител, за да се използва за изследване: макар да са изложени на по-висок риск, мнозина с две копия на алел APOEε4 никога не стават жертва на болестта на Алцхаймер. Но тестът за APOEε4 се използва в клиничната практика за по-сигурното диагностициране на болестта на Алцхаймер. И може би, щом разберем причината, генетичният анализ ще бъде по-рафиниран. Най-новите изследвания, свързани с предизвикване на симптоми на болестта на Алцхаймер при мишки навеждат на мисълта, че APOE е свързан с метаболизма на протеина, който причинява смъртта на нервните клетки при страдащите от тази болест хора.
А лечението? При повечето вродени заболявания се сблъскваме със същото съкрушително безсилие, което вече бе споменато във връзка с болестта на Хънтингтън: знаем достатъчно, за да ги диагностицираме, евентуално — и да ги избягваме, но не и да ги лекуваме. За щастие, има няколко случая, при които генетичното разбиране ни позволи да изминем и останалата част от пътя и да създадем ефикасни терапии. За нещастие, малко от тях са толкова прости и ефективни, както терапията на ФКУ, при която нормалният живот се постига благодарение на няколко хранителни ограничения.
Често генетичните болести водят до унищожаването, клетка по клетка, на едни или други тъкани: мускулите при мускулната дистрофия на Дюшен, нервните клетки при болестите на Хънтингтън и на Алцхаймер. Не съществува бърз начин за справяне с това безмилостно разрушение. Но макар още да сме в самото начало, смятам, че е напълно реалистично в крайна сметка да бъдем в състояние да лекуваме подобни болести, използвайки стволовите клетки. Повечето клетки в тялото са способни да възпроизвеждат само самите себе си — клетките на черния дроб например, произвеждат само чернодробни клетки — но стволовите клетки могат да генерират различни специализирани клетъчни типове. В най-простия случай, току-що оплодената яйцеклетка, стволовата клетка с максимален потенциал, в крайна сметка ще доведе до създаването на всичките познати 216 вида човешки клетки. Затова стволовите клетки се получават по-лесно от зародишите; могат да се открият и в зрели организми, но при тях обикновено липсва характерната за ембрионните клетки способност да се превръщат във всякакъв тип клетки. Тепърва започваме да се учим как да стимулираме стволовите клетки да произвеждат конкретен вид клетки и се надявам един ден да сме в състояние да заместим изгубените мозъчни клетки при хората, поразени от болестите на Хънтингтън и Алцхаймер с нови, здрави клетки. Но трябва да изминем дълъг път, преди да проумеем молекулярните причини, поради които дадена клетка се развива в една, а не в някоя друга посока. Ще бъдат нужни десетина години за справянето с този фундаментален проблем на биологията на развитието, преди да сме в състояние да изследваме както трябва терапевтичната стойност на стволовите клетки. Мисля, че би било истинска трагедия за науката и за хората, които биха имали полза от изобретената въз основа на стволовите клетки терапия, ако изследванията бъдат възпрепятствани поради религиозни причини. Проучванията показват недвусмислено, че повечето американци са за изследванията с помощта на стволови клетки от ембриони, но политиците продължават да угаждат на противопоставящото се религиозно малцинство. Резултатът е ограничаващото законодателство в Съединените щати, което застава на пътя на усилията за разработването на тази потенциално безценна технология.
Засега лечението на генетични заболявания не се простира до заместването на клетките чрез терапията със стволови клетки, но би могло да включва заместването на липсващ протеин. Болестта на Гоше, която поразява 1 на 40 000 човека, е резултат на мутация в гена за глюкоцереброзидазата — ензимът, подпомагащ разграждането на мастна молекула, която иначе се акумулира с вредни последствия в клетките на тялото. Болестта може да бъде опустошителна, с поредица от симптоми, в това число болки в костите и анемия. Първите опити за директно доставяне на липсващия ензим се правят още през 1974 година. Резултатите са обещаващи, но снабдяването с него е извънредно трудно: ензимът заместител трябва да се извлича от човешка плацента и за да се посрещнат нуждите само на един човек за една година са нужни двайсет хиляди плаценти. Големият пробив е осъществен в началото на деветдесетте години, когато изследователите синтезират модифицирана форма на ензима, която се усвоява по-ефикасно от нуждаещите се от него клетки. През 1994 година биотехнологичната компания Genzyme започва да произвежда модифицираната форма чрез рекомбинантни методи. Лечението на болестта на Гоше не се справя с генетичния корен, а по-скоро с ефекта от мутацията: то осигурява на пациента жизненоважния ензим, който не му осигурява мутиралият ген.
Оправянето на генетични аномалии по този биохимически начин очевидно е постижимо и ефективно. Но въпреки забележителната ефективност на рекомбинантните методи, лечението е скъпо — 175 000 $ годишно — а необходимостта от непрестанни вливания е бреме за пациентите. Затова е напълно естествена мечтата на генетиците да открият практичен начин за справяне с причината за проблема, вместо да компенсират последствията от него. Идеалното лечение за вродените заболявания би било осъществяването на генетична промяна, на коригиране на причиняващите проблеми гени. А ползата от такава генна терапия би траяла през целия живот на пациента; веднъж оправен, проблемът ще бъде решен завинаги. Съществуват, поне по принцип, два подхода: соматична генна терапия, при която променяме гените в клетките на тялото на пациента; или генна терапия на яйцеклетката или сперматозоида, при която се променят гените в сперматозоидите или яйцеклетките на пациента, за да се предотврати предаването на вредната мутация на следващото поколение.
Тези решения за справяне с генетичните дефекти може да са очевидни, но идеята за генната терапия не бе посрещната особено топло както от масовата публика, така и от професионалистите. Подобна реакция не е изненадваща: може да се очаква, че култура, която се притеснява от генни модификации в царевицата, ще бъде против генно модифицираните хора, колкото и голяма да е потенциалната полза. А най-бурните протести са срещу генната терапия с линии микроорганизми поради риска да се причинят генетични вреди при манипулирането на ДНК. При соматичната генна терапия вредата ще има ограничен ефект; при генната терапия с линии микроорганизми съществува вероятност по случайност да се създадат увредени хора. Но дори нейните поддръжници, сред които се смятам и аз, никога не биха предложили да се пристъпи към тази процедура, преди да разполагаме с достатъчно добри техники, за да сме уверени, че няма да причиним неволно вреда. Много учени обаче са убедени, че никога не трябва да се захващаме с генна терапия с линии микроорганизми. Независимо дали се основават върху етиката или неоснователни страхове от неизвестното, подобни аргументи според мен не са необорими. Генната терапия с линии микроорганизми е всъщност оправяне на това, което случайността е объркала. Но засега споровете са академични: генната терапия с линии микроорганизми е все още много над техническите ни възможности. Докато това стане, трябва да съсредоточим усилията си върху превръщането на соматичната генна терапия в мощно средство.
Първата явно успешна генна терапия е осъществена от Френч Андерсън, Майкъл Блийз и Кен Кълвър от Националните здравни институции през 1990 година. Те избират една много рядка болест, наречена „аденозин деаминазен дефицит“ (АДА), при която липсата на един ензим изважда от строя имунната система и оставя потърпевшия беззащитен като Дейвид Ветър, момчето в найлоновия мехур. В експеримента участват две момиченца: четиригодишната Ашанти Десилва и деветгодишната Синди Кътшал.
 Синди Кътшал, пациентката пионер в генната терапия. След посещението си в Колд Спринг Харбър, тя ми изпрати рисунка, където ме изобразява в действие.
Синди Кътшал, пациентката пионер в генната терапия. След посещението си в Колд Спринг Харбър, тя ми изпрати рисунка, където ме изобразява в действие.
Как се вкарва нов ген в пациент? По това време най-логичното средство изглеждат ретровирусите. По принцип вирусите са ефикасни генетични вектори; те се препитават, като инжектират ДНК в други клетки. Ретровирусите са специална група, която има като генетичен материал РНК вместо ДНК. Но докато повечето вируси заразяват дадена клетка, възпроизвеждат се и след това я убиват, когато „дъщерните“ вируси излизат да инфектират други клетки, ретровирусите в типичния случай са по-мили, поне към клетката-приемник: новите вирусови копия се пръскат, без да я унищожат. Това не означава непременно, че ретровирусът се понася по-лесно от организма-приемник; понякога става точно обратното, както знаем от горчивия си опит с HIV, може би най-добре познатия ретровирус. То обаче означава, че вирусните гени, както и допълнителните гени, които вирусът може би ще се наложи да пренесе, ще се превърнат в постоянна част от генома на неунищожената клетка. Генното инженерство е създало възможно най-безопасни ретровируси за генната терапия; лишени от всички вирусни гени, които не са необходими за навлизането в генома на клетката-приемник — а те имат невероятни средства за осъществяването на тази задача — ретровирусите се превърнаха в идеалния генен вектор.
Остава обаче проблемът как да насочим ретровирусите само към засегнатите от мутацията клетки, които се нуждаят от гена-заместител. Днес това е най-голямото предизвикателство пред генната терапия: как да се насочи добрият ген в мускулните клетки, за да бъде излекувана мускулната дистрофия на Дюшен, в белодробните клетки, за да се справим с кистозната фиброза, или в мозъчните клетки за пациентите с болестта на Хънтингтън? Затова изборът на озадачаващата болест АДА за първата генна терапия бе много разумен: целевите клетки в този случай са леснодостъпни — циркулиращите из кръвта клетки на имунната система. Екипът на Андерсън успява да извлече милиони имунни клетки от кръвта на момиченцата и да ги отгледа при лабораторни условия, където да бъдат заразени с ретровирус, носещ функционално копие на гена. Веднъж щом естествената ДНК на клетката инкорпорира вирусовия геном, носещ гена-заместител, клетките са готови да бъдат вкарани отново в кръвта на пациентките.
През септември 1990 година Ашанти Десилва е подложена първа на процедурата; терапията на Синди Кътшал се осъществява четири месеца по-късно. На всеки няколко месеца на момиченцата се вливат генетично преобразени имунни клетки. Същевременно продължава негенетичната ензимозаместваща терапия — начинът, по който се третират пациентите с болестта на Гоше, но в по-ниски дози. Тази предпазна мярка се изисква от Подкомитета за генна терапия на човека към Националните здравни институции; той настоява, съвсем основателно, че е опасно момичетата да бъдат оставени единствено на все още новата, непроверена терапия, без подсигурителна мрежа. Но експериментът, макар да не се контролира съвършено, изглежда има успех: състоянието на имунната система и на двете деца се подобрява и те вече са в състояние да се справят с по-незначителните инфекции. Аз мога да потвърдя лично, че Синди Кътшал изглеждаше съвсем здраво единайсетгодишно момиченце, когато през 1992 година посети със семейството си Колд Спринг Харбър. Единайсет години по-късно обаче, резултатите не са напълно убедителни. Имунната система на Десилва се приближава до нормалното функциониране, но само около 1/4 от нейните Т-клетки са резултат от генната терапия. Кръвта на Кътшал съдържа дори още по-малка пропорция Т-клетки от генната терапия, макар имунната й система да работи добре. Трудно може да се каже обаче до каква степен по-доброто състояние на момичетата се дължи на генната терапия и доколко — на непрестанното добавяне на ензими заместители. Резултатите са прекалено неопределени, за да се приемат безрезервно като ясно доказателство за успеха на генната терапия.
Случаят на Кътшал/Десилва не е единственият, в който Националните здравни институции се налагат в света на генната терапия. Подкомитетът за генна терапия на човека към Националните здравни институции е създаден през 1980 година в отговор на първия опит за генна терапия. Той се проваля и предизвиква такива спорове, че правителството за малко не решава да задуши новородената инициатива в люлката. Човекът в центъра на бурята, Мартин Клайн, е умен, амбициозен лекар, посветил се на облекчаване страданията на своите пациенти. Специалният му интерес е бета-таласемията, хемоглобинопатията, описана от Бърнадет Модъл въз основа наблюденията на общността на кипърските гърци в Лондон. След успешни опити с животни, Клайн, който работи в Калифорнийския университет в Лос Анджелис, кандидатства за разрешение да изпробва генната терапия върху хора, като използва нерекомбинантна ДНК. Докато молбата все още се разглежда, усърдният Клайн урежда да лекува две жени извън Съединените щати — едната в Израел, а другата в Италия, но използва рекомбинантни гени, чиято употреба е все още забранена според директивите на Националните здравни институции. При връщането си в Лос Анджелис той открива, че молбата му е отхвърлена; според приемната комисия трябва да бъдат представени още факти от опити с животни, преди да бъде разрешено да се изпробва и върху хора. Оказва се, че Клайн е нарушил буквално всички правила: не само си е позволил да лекува хора без разрешение, ами е използвал и недвусмислено забранен метод. Клайн трябва да понесе последствията: изгубва финансирането от държавата и е принуден да си подаде оставката като декан на своя факултет. Генната терапия изгубва първия лекар, който я прилага.
Епизодът с Клайн съвсем не е последният, в който опиталите да приложат генната терапия учени си навличат неприятности със закона. Трагичното е, че едва след смъртта на един пациент при подобни опити до съзнанието успява да достигне отрезвяващото послание: генната терапия, този сложен коктейл от вируси, фактори на растежа и пациенти, е опасна. Но съдържанието на посланието е дори още по-всеобхватно: тъй като в уравнението на генната терапия има толкова много неизвестни, стриктният контрол над всички процедури, свързани с хора, е абсолютно необходим. Джес Гелсингер умря, защото не знаем достатъчно, за да предвидим с пълна увереност индивидуалната реакция на генната терапия и защото учените направиха непростими опити да съкратят пътя.
През 1999 година живеещият в Аризона Гелсингер научава за опита, провеждан от Джеймс Уилсън, директор на Института за генна терапия на човека към Пенсилванския университет. Гелсингер страда от дефицит на орнитин транскарбамилаза (ОТК), наследствено нарушаване на способността на черния дроб да преработва уреята, естествен продукт от белтъчния метаболизъм. Оставено без лечение, заболяването може да бъде смъртоносно и макар, подобно на ФКУ, да е възможно да се регулира с лекарства и подходяща диета, ОТК прави своите жертви особено уязвими от други заболявания. Случаят на осемнайсетгодишния Гелсингер е от сравнително по-леките, но досегът му до смъртта от детството, в резултат от неговото състояние, му дава смелост да се включи в експеримента като доброволец с надеждата да спомогне за откриването на лек за себе си и за другите като него. Пенсилванската терапия използва един аденовирус (член на групата, причиняваща обикновената настинка) като вектор на коригирания ген. Но няколко часа след като вирусите, носещи нормален вариант на ОТК гена, са инжектирани в черния му дроб, Гелсингер вдига висока температура. Последва яростна инфекция, съпроводена от кръвни съсиреци и чернодробен кръвоизлив. Три дена след инжектирането Джес Гелсингер е мъртъв.
Смъртта на юношата е шок не само за неговото семейство, а и за изследователската общност. Детайлното разследване разкрива сериозни процедурни пропуски. Може би най-фрапиращ е следният факт: макар двама пациенти да проявяват признаци на чернодробно натравяне в по-ранен етап на същото изследване, това не се докладва на отговарящите за регулацията власти и не се разкрива пред доброволците. Ако беше предупреден, Джес Гелсгингер може би щеше да размисли повторно, преди да кандидатства като доброволец, и днес щеше да бъде още жив. Трагедията нанася сериозен удар върху прогреса на генната терапия. За известно време Администрацията по храните и лекарствата на САЩ спира всички подобни опити в университетските и другите програми в страната. Бил Фрист от Тенеси, единственият лекар в Сената, организира разследване с цел да се докладват процедурите при опитите с хора; президентът Клинтън призовава стандартното „информирано съгласие“ да бъде усъвършенствано, така че участниците в експериментите да бъдат напълно запознати с потенциалния риск. Ако от смъртта на Джес Гелсингер произлезе нещо добро, то е затягането на държавния контрол върху опитите с хора.
Общността, занимаваща се с генна терапия, все още се олюляваше от причинената от смъртта на младежа ударна вълна, когато от Франция дойде окуражаваща новина, свързана с тежкия комбиниран синдром на имунен дефицит (ТКСИД), имунната недостатъчност, обрекла Дейвид Ветър на живот в найлонов мехур. Макар трансплантацията на костен мозък да има успех — първият страдащ от въпросното заболяване, на когото е присаден костен мозък през 1968 година, е здрав и до днес — успехът е само в около 40% от случаите, и дори тогава може да завърши трагично, какъвто бе случаят с Дейвид Ветър. През 2000 година екип под ръководството на Ален Фишер в болницата „Некер“ в Париж осъществява генна терапия на две бебета, които, подобно на Дейвид, се намират в пълна изолация от своето раждане. Както при третирането на аденозин деаминазния дефицит (АДА), се използва ретровирус, който да пренесе нужния ген в извлечените от бебетата клетки, след което клетките се връщат обратно. Забележителното нововъведение обаче е, че френската група взема клетките за модифициране от костния мозък на децата. Ако се увенчае с успех, използването на имунните стволови клетки от костния мозък вместо обикновените Т-клетки, които се намират в кръвта, обещава да осигури самовъзпроизвеждащо се генно решение. Когато се възпроизвеждат, стволовите клетки увеличават не само своя брой, но и броя на специализираните соматични клетки, в които се обособяват по естествен начин. Следователно всички Т-клетки, произведени от модифицирани стволови клетки, също ще носят вкарания ген и по този начин ще направят ненужни многократните вливания на модифицирани клетки.
 Когато всички новини са хубави: Ален Фишер и Марина Кавазана-Калво обявяват триумфа си в областта на генната терапия през април 2000 година.
Когато всички новини са хубави: Ален Фишер и Марина Кавазана-Калво обявяват триумфа си в областта на генната терапия през април 2000 година.
И точно това и става: десет месеца по-късно и в двамата малки пациенти са намерени Т-клетки, съдържащи работещо копие на липсващия ген, и имунните им системи действат така добре, както при всяко нормално дете. Оттогава методът на Фишер се прилага и при други деца с ТКСИД. След продължителен и не особено обнадеждаващ старт, генната терапия най-после бележи неоспорим успех. Но празненството не трае дълго. През октомври 2002 година лекарите установяват, че единият от двамата първи пациенти страда от левкемия, рак на костния мозък, при който някои видове клетки се произвеждат в прекалено големи количества. Макар да не бе установено със сигурност дали виновна за това е генната процедура, косвените улики са доста убедителни. Както изглежда, генната терапия успя да излекува ТКСИД на бебето, но страничният ефект от нея се изрази във вид на левкемия.
Страничните ефекти винаги са преследвали медицината. Лекарствата могат да засегнат не само конкретната си цел, а хирургическите процедури — да предизвикат усложнения. Макар в много отношения да се отклонява от традиционната, и генната медицина, както вече знаем, е подчинена на същия закон на неумишлените последствия. Лечението на Фишер на ТКСИД вероятно неволно е създало нови проблеми в процеса на справяне с първоначалните. По принцип лечението, изискващо вкарването на вирусна ДНК в клетъчната ДНК на пациента, е рисковано, защото чуждата ДНК може по някаква случайност да наруши функционирането на жизненоважен ген. Тъй като обикновено клетката, в която се случи нещо подобно, умира, тези събития не се отразяват на целия организъм. Възможно е обаче елиминирането на разрушения ген да не убие клетката, а да отключи възможността й да се дели неконтролируемо: вкарването на вируса може да причини рак. Както изглежда именно това се е случило с болното от ТКСИД бебе.
Може би трябва да се извърви още доста дълъг път, преди генната терапия да бъде в състояние да върши чудесата, предвиждани в зората на генната революция. Смъртта на Джес Гелсингер причини сериозни затруднения. Левкемията, страничен ефект от лечението на ТКСИД обаче ще навреди още повече. Както изглежда, вината в случая с Гелсингер е предимно в непростимо лошото ръководство на опитите — проблем, който се надяваме да се оправи чрез по-строгото законодателство. Засега обаче няма решение на проблема със страничния ефект. Вероятно ще трябва да разчитаме на депресиращите данни, отнасящи се за този случай: генната терапия поне е излекувала заболяване, ТКСИД, по-лошо от това, което е причинила. Добрата новина е, че въпросното момченце очевидно реагира добре на химиотерапията, използвана за лечение на левкемията. Но покрай инцидентите с Гелсингер и левкемията изкристализираха доста въпроси, които тепърва очакват своето решение, ако искаме соматичната генна терапия да навлезе стабилно в медицината. И тъй като не съм толкова наивен, съм наясно, че бъдещите опити най-вероятно ще разкрият още трудности. Ще мине време, преди да можем да твърдим извън всякакво съмнение, че сме неутрализирали всички въображаеми опасности. Въпреки това вярвам, че потенциалът на тази технология да ни освободи от проклятието на генетичните болести е прекалено голям, за да се отказваме от нея.
Вашата ДНК може да разкаже много неща. Както видяхме, ако в семейството ви има заболели от болестта на Хънтингтън, вашата ДНК буквално е в състояние да разкрие бъдещето ви; ако притежавате конкретен вариант на даден ген (или комбинация от гени), ДНК може да ви осведоми твърде бързо за относителния риск да станете жертва на най-разпространените убийци като сърдечните заболявания. Вариантът ви на гена за аполиппротеин E вече може да се използва като средство за предсказване на Алцхаймерова болест. Но трябва ли да се притеснявате дали тази дълбоко лична информация няма да се използва срещу вас? За много американци най-голямата тревога е, че един ден генният им профил може да стане причина да им бъде отказано здравно застраховане.
През 2000 година „Американ Джърнъл ъв Хюмън Дженетикс“ публикува резултатите от следното проучване: на здравни осигурители се задава въпросът дали биха променили таблиците си за здравно осигуряване съобразно генната информация, ако стане достъпна за тях. Биха ли изисквали по-големи вноски от клиент в съвършено здраве, но носител на мутация, която го предразполага към едно или друго заболяване? Около две трети от запитаните признават, че биха постъпили точно така. Останалата трета най-вероятно просто е излъгала. Застрахователните компании не са място за проява на филантропия, а за бизнес, и трябва да се съобразяват с интересите на своите акционери. Няма причина да се предполага, че оставени да постъпват както им се иска, те не биха направили това, което са правили винаги: да увеличат максимално застрахователните вноски на рисковите категории и да избягват изобщо клиентите, за които има най-голяма вероятност да получат застраховката. Същият репортаж описва случай, при който една застрахователна компания увеличава вноските на свой клиент, защото подозира, че е носител на генетично заболяване, само защото той си прави диагностичен тест за болестта на Хънтингтън.
Неизбежно ли е, в резултат на опознаването ни на молекулярно ниво, изтеглилите непечеливш билет в генетичната лотария да трябва да плащат по един или друг начин? Освен това подобна злоупотреба няма да се ограничи единствено със застрахователите. Ако ДНК профилът ми показва, че има вероятност да получа инфаркт или инсулт, да стана алкохолик или да получа клинична депресия, потенциалният ми работодател може да реши, че е прекалено рисковано да ме наеме.
Подобни въпроси навеждат на мисълта, че Brave New World може да се превърне в действителност много преди настъпването на XXV век, както е във въображението на Хъксли. ДНК е сериозен факт от живота на XXI век, дух, който няма как да бъде върнат обратно в бутилката. Решението какво да правим с него обаче, зависи от нас, защото живеем в демократично общество. За нещастие, в такива общества законите обикновено се създават или променят доста след възникването на нуждата от това: в повечето случаи светофар се слага на опасно кръстовище едва след поредица от злополуки. Може би ще бъдат нужни няколко истории на ужаса, където е допусната огромна несправедливост, за хора, превърнати в жертви на своя геном, за да бъде мотивирано приемането на подходящи закони. Как би трябвало да изглеждат те? Запазването на генетичната тайна трябва да бъде мерило, но не непременно крайната цел. Налага се да бъде постигнат баланс с другите обществени приоритети, сред които не на последно място борбата с болестите, чийто напредък ще зависи във все по-голяма степен от предоставянето на изследователите в тази област на достъп до цялата генетична информация, която може да бъде събрана от населението. Законодателството не би трябвало да съкруши амбицията ни да изследваме пълния потенциал на ДНК за облекчаване на човешкото страдание, нито е в състояние да ни даде някаква информация за нас самите и нашия произход, или да идентифицира извършителите на престъпление, но трябва да осигури най-малкото нито един гражданин да не бъде лишен от граждански или човешки права заради написаното в гените му.
Междувременно е утешително да се знае, че въпреки огромната генетична информация, с която се разполага вече, и независимо от отговорите, дадени на статистиците, застрахователните компании като цяло не показват особен стремеж да се съобразяват с генетичните фактори при определянето на застрахователните вноски. Светлата кожа, която съм наследил, ме издава като по-податлив на рака, но засега все още не са ми искали по-високи застрахователни вноски заради нея. Отново мотивацията е бизнесът, а не благотворителността. По традиция застрахователите определят големината на вноските, използвайки статистически таблици, преценяващи здравето и продължителността на живота предимно по начина ни на живот. Подозирам, че дори генетичната информация да бе достъпна за всички, за застрахователите определени фактори от начина на живот, като дали човекът пуши, дали работи в каменовъглена мина или в цветарски магазин и тъй нататък, ще си останат значително по-показателни за риска за здравето на отделния индивид от объркващото количество сравнително тънки разлики, определени от генетичните вариации между хората. Неоспоримо е, че тези, чиято ДНК разкрива неизбежна болест, се нуждаят от специална законова защита, но предразположението към сърдечни заболявания и рак със сигурност ще се окаже толкова разпространено и сложно, че ще бъде непрактична основа за дискриминиране на хората с цел намаляване на разходите. Базата на застрахователното дело е, че броят на щастливците, които си правят вноските до края, ще бъде достатъчно голям, за да покрие разходите за малцината нещастни люде, които ще получат цялата сума, преди да са я изплатили; малко вероятно е тази база да бъде разрушена от натрупването на генетична информация.
Но дори личните ни права да бъдат подсигурени срещу онова, което е в състояние да разкрие нашата ДНК, покоят ни не може да бъде възстановен така лесно; както Нанси Уекслър знае много добре, генетичното знание може да бъде доста страховита перспектива. И аз съм съгласен с нея: няма смисъл да се осведомим за нещо, ако не сме в състояние да го поправим или подобрим. Алцхаймер е голяма грижа за хората на моя възраст, но при липсата на доказани възможности за лечение, нямам желание да бъда тестван за наличие на алел APOEDε4. Крейг Вентър несъмнено има едно копие от него. Разбрахме го, защото той настоя да разкрие, че секвенционираният от Celera геном е неговият. И този алел, поради ролята си в преработката на холестерола, е свързан не само с по-високия риск от Алцхаймерова болест, но и с редица сърдечни заболявания. (APOEε4 не е актив в никое отношение.) Оказал се така осведомен за състоянието на своите гени, Вентър се старае мъдро да наблегне върху профилактиката: взема лекарства, наречени „статини“, които понижават нивото на холестерола и биха могли да забавят или да предотвратят появата на болестта на Алцхаймер. Макар да не съм осведомен за състоянието на моите APOE алели, аз също приемам статини, защото смятам, че превантивното вземане на някакви лекарства няма да ми навреди. Ако статините са толкова ефективни, колкото твърдят някои, очакват ни още доста години на противоречия, предизвикани от Вентър (и, надявам се, и от Уотсън).
Генетичните знания ще продължават да ни се струват плашещи, докато се намираме в сегашния преходен етап и сме в състояние да диагностицираме, но не и да лекуваме. Подобно нещо обаче, не се случва за първи път в човешката история. В началото на двайсети век например диагностицирането на диабет при малкото дете е било равносилно на смъртна присъда. Днес, благодарение на инсулиновата терапия, тези деца имат възможност да доживеят до старини. Учените продължават да полагат усилия в тази област с надеждата, че не след дълго и съдбата на диагностицираните с болест на Хънтингтън ще бъде трансформирана по същия начин — от смъртна присъда до лекарска рецепта.
Вече сме в състояние да се справяме значително по-добре с изтеглянето на губещ билет в генетичната лотария, отколкото дори само преди двайсет години. Доказателство за този прогрес е непрекъснато нарастващата средна продължителност на живота на хората със синдрома на Даун или с кистозна фиброза. Но засега най-мощното ни оръжие е диагностицирането. Изборът дали да бъде тестван е най-добре да бъде оставен на всеки един и на родителите, тоест на хората, които ще трябва да понесат тежестта на генетичната информация. Колкото до пренаталното диагностициране, изборът трябва да принадлежи на бъдещата майка. Това не означава, че другите не би трябвало да участват, но в крайна сметка изборът е право на жената, защото тя не само ще износи и роди бебето, ами и, както все още се очаква от жената и в съвременното общество, тя ще понесе основната тежест при отглеждането му. Независимо от спецификата на вземане на решение обаче, едно нещо ми е абсолютно ясно: генетичните болести са причинили неописуемо страдание на безчет семейства като на това на Каръл Кар, съсипано от болестта на Хънтингтън. Тестването дава възможност да намали нещастието, като го предотврати. Непростимо е, след като много тестове вече са разработени, тези, които може би биха ги използвали, да не бъдат осведомени за тяхното съществуване или тестовете да не бъдат достъпни по целия свят за всички.