Метаданни
Данни
- Включено в книгата
- Оригинално заглавие
- DNA: The Secret of Life, 2003 (Пълни авторски права)
- Превод отанглийски
- Красимира Матева, 2004 (Пълни авторски права)
- Форма
- Научен текст
- Жанр
- Характеристика
-
- Няма
- Оценка
- 5,6 (× 12гласа)
- Вашата оценка:
Информация
Издание:
Джеймс Д. Уотсън, Андрю Бери. ДНК — Тайната на живота
Редактор: Таня Боянова
Коректор: Ангелина Вълчева
Дизайн на корицата: Бисер Тодоров
Предпечат: Таня Петрова, Бисер Тодоров
ИК „ИнфоДАР“ ЕООД, 2004 г.
ISBN: 954-761-148-8
История
- —Добавяне
Единайсета глава
Лов на гени: Генетиката на човешките болести
Беше прекалено рано през деня някой вече да е пиян, още повече една безупречно облечена жена на средна възраст. Но тя се поклащаше нестабилно на улицата и явно полицаят също реши, че е пияна, затова я смъмри заради публичния спектакъл. Но Лионора Уекслър не беше пияна. Очевидно и тя щеше да стане жертва на ужасната съдба, унищожила вече няколко близки роднини пред очите й, съдба, която се бе надявала, че ще я отмине.
Скоро след това, през 1968 година, бившият съпруг на Уекслър, Милтън, ще празнува шейсетия си рожден ден в Лос Анджелис заедно с двете им дъщери, Алис на 26 години и Нанси на 23 години. Оказва се обаче, че този ден няма да бъде радостен. Милтън съобщава на дъщерите си, че петдесет и тригодишната им майка страда от болестта на Хънтингтън, опустошително неврологично заболяване, причиняващо прогресивно влошаване на мозъчните функции, докато засегнатият постепенно губи всякаква представа за самия себе си и за любимите си хора. Той губи също контрол върху своите крайници; първо се засяга ходенето, както бе показано в случая с Лионора, но с влошаване на състоянието пациентите започват да правят неволни, отривисти движения. Не съществува лечение, което да забави безмилостното плъзгане надолу към смъртта.
Едва сега Алис и Нанси си обясняват някои обезпокоителни факти около роднините на майка си, както и намеците й, че не всичко в семейството е наред. Те знаят, че вуйчовците им, тримата братя на Лионора, са умрели млади; преди края на лицето на всеки един от тях се е образувала една и съща странна гримаса, и тримата се движели нестабилно и говорели завалено. Знаят, че бащата на Лионора, дядо им Ейбрахам Сабин, също е умрял млад, макар Лионора умишлено да не бе споменавала, че същите признаци са се проявили и при него. Очевидно болестта на Хънтингтън се предава от поколение на поколение в семейството. На Милтън се пада мрачната задача да отговори на въпроса, който му задават още същия ден: каква е вероятността Алис и Нанси също да се разболеят от нея. „Петдесет на петдесет“ — отвръща той.
Покосилата Ейбрахам Сабин и неговите потомци болест е идентифицирана за първи път от Джордж Хънтингтън. Роден в лекарско семейство, Хънтингтън израства в Ийст Хамптън, Лонг Айлънд, където, още като момче, придружава баща си при неговите обиколки из домовете на болните. След като завършва медицина в Колумбийския университет, Хънтингтън поема семейната практика на Лонг Айлънд, но след няколко години се премества в Поумрой, Охайо. През 1872 година представя доклад пред Академията по медицина в близкия Мидълпорт, озаглавен „За хореята“. „Хорея“ на гръцки означава „танц“ и с тази дума медиците от XVII век назовават болестите, предизвикващи резки, неконтролируеми движения в своите жертви. Вече на преклонна възраст Хънтингтън споделя как е бил омаян от мистериозната болест:
Преди повече от петдесет години, когато съпровождах баща си при неговите обиколки в домовете на болните, се сблъсках за първи път с „онова разстройство“, както местните хора наричаха винаги таза страшна болест. Спомням си всичко така живо, сякаш беше вчера. Случаят се запечата в момчешкото ми съзнание и именно този отпечатък бе началният импулс да избера хореята като първия си принос в лоното на медицината. Докато с баща ми пътувахме по гористия път от Ийст Хамптън за Амагансет, внезапно се натъкнахме на две жени, които се накланяха, гърчеха се, гримасничеха. Вперих в тях учуден поглед, почти обзет от ужас. Какво можеше да означава това? Баща ми спря да поговори с тях и после ги отминахме. Тогава започна обучението ми по метода на Гамалиил[1]. От този момент нататък интересът ми към болестта никога не е преставал напълно.
Като привежда както собствените си наблюдения, така и клинични бележки на баща си и дядо си (оригиналният ръкопис има анотации, нанесени с молив от баща му), младият лекар предлага в доклада си майсторско описание на това, което ще стане известно като „Хънтингтънова хорея“ или, в по-нови дни — „болест на Хънтингтън“. Специфичните за хореята движения, обяснява той, „постепенно нарастват, след това незасегнатите до този момент мускули започнат да извършват спазмодични действия, докато бъде засегнат всеки мускул в тялото“. Той отбелязва придружаващото ги влошаване на умственото състояние така: „С напредването на болестта мозъчните функции се влошават повече или по-малко и мнозина достигат до безумие, докато при други тялото и мозъкът постепенно стават все по-безпомощни, докато най-сетне смъртта ги избави от страданията.“ Също така установява, че болестта е наследствена: „Когато един или двамата родители проявят признаци на болестта, едно или повече от децата неизменно се разболява от нея. Тя никога не пропуска дадено поколение, за да се прояви при следващото. Поддалият й се веднъж никога повече не се възстановява.“
Хънтингтън определя правилно ключовите характеристики на този тип генетично заболяване. Той установява, че то засяга както мъже, така и жени и се предава от поколение на поколение. Вероятността детето на страдащ от Хънтингтънова болест родител също да бъде поразено е 50:50. Но някои семейства изтеглят щастливия билет и в тях никой не се разболява, докато в други не е пощаден нито един. Ако човек не наследи анормалния ген от някой родител, няма да го предаде на следващото поколение. Днес знаем, че болестта на Хънтингтън се причинява от мутация и тъй като генът не се проявява преференциално в представителите на единия или другия пол (тоест не е свързан с пола), нашето предположение е, че засегнатият ген не е нито на X, нито на Y хромозомата. Нека наречем нормалния вариант на гена H, а мутиралия — h. Имаме две копия на всяка неполова хромозома (наречени „автозоми“) и следователно — две копия от Хънтингтъновия ген. Хората с две копия от нормалния ген (HH) не са засегнати от болестта. Но хората с две (hh) или дори с едно (Hh) копие на мутиралия ген в един или друг момент на живота си ще се разболеят от въпросната болест. Наричаме този модел „автозомална доминантна наследственост“. („Доминантна“ означава, че само едно копие от гена е достатъчно, за да причини заболяване — анормалният ген доминира над своя нормален партньор.)
Тъй като е много по-вероятно човек да наследи едно, а не две копия на мутиралия вариант, повечето страдащи от болестта на Хънтингтън хора са Hh. Те ще предадат на децата си H или h, тоест вероятността дадено дете да бъде засегнато от нея е 50%, точно както обяснява Милтън Уекслър на дъщерите си Алис и Нанси.
През 1968 година за болестта на Хънтингтън не се знае кой знае колко повече освен следните факти: тя е наследствена и процесът е необратим, защото убива нервни клетки в определени участъци на главния мозък. Милтън Уесклър решава да направи нещо във връзка с поразилия семейството му ужас: той създава фондация „Вродени заболявания“ за набиране на средства и настоява правителството също да финансира изследванията на болестта на Хънтингтън. Дъщеря му Нанси също е привлечена към делото. Докато работи върху доктората си по психология в Мичиганския университет, тя започва да участва все по-активно в дейността на фондацията. През седемдесетте години на XX век, когато става очевидно, че истинският напредък зависи от по-доброто проумяване на генетиката на болестта, Нанси Уекслър започва да се преквалифицира като генетик.
На брега на езерото Маракайбо във Венецуела тежестта на невероятната мизерия се подсилва от забележително високия процент болни от тази болест. По всичко изглежда, че ако болестта на Хънтингтън разкрие някога своите тайни, това ще бъде край езерото Маракайбо. През 1979 година Уекслър започва да събира ДНК проби и да записва семейни истории с цел да изготви генеалогични дървета на всички засегнати. Това е много работа за генетика, но за Уекслър, дъщеря на жертва на болестта на Хънтингтън, изправена пред 50% вероятност също да бъде поразена от нея, това означава още много неща. Означава да гледа познатото в толкова необичайна обстановка: хората, живеещи над езерото в дървени наколни колиби с тенекиени покриви, се движат със същото типично пиянско залитане като майка й. От първото си пътуване до езерото Маракайбо през 1979 година, Уекслър се връща там всяка година, за да продължи работата си. Хората, с които работи там, я наричат „La Catira“ заради дългата й руса коса. Според венецуелския й колега Америко Негрете, който първи съобщава за невероятно често срещащата се болест на Хънтингтън около езерото, тя превръща всички в едно голямо семейство, като всеки път ги поздравява „без театралничене, без преструвки, без поза. А с нежност, бликаща от очите й.“
Но нежността е в състояние само да смекчи опустошението, нанесено от болестта върху толкова много хора. Целта на експедициите на Уекслър е в крайна сметка да открие отговорния за болестта ген. Но как могат генеалогичните й дървета на хората около Маракайбо да идентифицират виновника? Ключът към това се крие в напредъка на науката за човешката генетика.
Уекслър и другите, проявяващи интерес към наследственото заболяване, са наясно, че ако искат да разберат кой точно е генът на болестта, трябва да направят с хората това, което Морган и неговите студенти са правили на времето с плодовите мушици преди повече от половин век. Както видяхме (в Първа глава), Морган сравнява честотата, с която конкретни генетични маркери — например бял (вместо червен) цвят на окото или къдрави (вместо прави) криле — се срещат сред поколението на кръстоски между родители, проявяващи различни комбинации от тези характеристики. Информацията му позволява да определя доколко близо са един до друг върху хромозомата гените, управляващи тези характеристики. Човешката генетика обаче пълзи далеч зад генетиката на плодовата мушица поради две основни причини. Първата е невъзможността, поради етични и практически основания, да се правят експериментите, представляващи основата на генетичния анализ: не е възможно да се сдобиете с две интересуващи ви човешки същества и след две седмици вече да анализирате тяхното поколение. Второ, дори хората да могат да бъдат кръстосвани по волята на учения, при тях пак липсват генетични маркери. Морган успява да проследи известен брой прости и очевидни разлики във вида, причинени от конкретни мутации в индивидуалните гени. За нещастие, хората не притежават много лесни за анализиране характеристики, наследявани по този прост начин; оказва се, че дори учебниковият пример, цветът на очите, се управлява от няколко, а не само от един ген. Нещо повече, нивото на генетично вариране при плодовите мушици може да се увеличи, като отделните индивиди се облъчат с рентгенови лъчи или бъдат подложени на въздействието на други мутагенни агенти; за щастие подобни възможности са недопустими при действието с хора. Едва рекомбинантната ДНК предлага решение на двете основни препятствия.
В ерата на секвенционирането на ДНК вече не е необходимо генетичните маркери да бъдат видими, като белите очи на плодовата мушица; вариацията в самата последователност е достатъчна, за да проследите този ДНК маркер по семейното дърво, тоест през различните генетични кръстоски, просто като анализирате ДНК от няколко поколения. Революцията започва в годината преди Уекслър да се заеме с генеалогичните си проучвания. И, както в толкова много случаи на научен напредък, не липсва и известна доза случайни открития.
Това се превръща в ежегоден ритуал: група специализанти от университета на Юта съпровождат своите научни ръководители до ски курорта Алта в Уозач Маунтин за интензивен семинар по въпросите на своето изследване (е, и да покарат ски в добавка). Обикновено се канят двама големи учени от други институции, за да оглеждат критично представяната от нервните студенти информация. През 1978 година големите имена са Дейвид Ботщейн от Масачузетския технологичен институт и Рон Дейвис от Станфорд.
Отбелязва се, че Дейвид Ботщейн „проявява тенденция към извънредно бързо мислене и говорене, често едновременно“. Рон Дейвис е мълчалив и затворен. През този април в Юта Ботщейн и Дейвис осъзнават заедно нещо важно. Докато слушат как специализантите на Марк Сколник обсъждат генетичните болести в извънредно големите родословни дървета на мормонските семейства, погледите на Ботщейн и Дейвис се срещат внезапно, защото двамата осъзнават едновременно едно и също нещо. Макар да са специалисти по дрождите, те виждат начин за локализиране на човешките гени! Те виждат всъщност как най-съвременните техники за рекомбиниране на ДНК ще им позволят да приложат при хората същия тип генетичен анализ, използван от Морган за изучаването на плодовата мушица. Всъщност ДНК маркерите вече се използват за картиране на гени при други видове, но Ботщейн и Дейвис първи прилагат потенциала на техниката при хората.
Техниката, наречена „анализ на свързването“, определя положението на даден ген във връзка с известната позиция на конкретни генетични „крайъгълни камъни“. Принципът е лесен: при липса на каквато и да било друга информация, ще ви бъде трудно да откриете Спрингфийлд на картата на Съединените щати, но ако ви кажа, че той се намира горе-долу по средата на пътя между Ню Йорк и Бостън, два ориентира, дадени на картата, задачата ви се улеснява значително. Целта на анализа на свързването е да направи същото с гените: той установява взаимовръзки между известни генетични маркери и неизвестните гени. Този метод има голям успех при плодовата мушица, но, както видяхме, недостигът на известни генетични маркери при хората не позволява да се използва при човешките заболявания… докато Ботщейн и Дейвис не осъзнават, че напредъкът в молекулярната биология дава решение на проблема.
ДНК маркерите, привлекли вниманието им, са ограничаващите дължината на фрагментите полиморфизми (ОДФП). Те стават, когато дадена ДНК последователност, срязана от определен рестрикционен ензим в един индивид, се промени в друга, така че вече не може да бъде срязана от въпросния ензим. (Спомнете си, че рестрикционните ензими са специфични за всяка последователност: ензим EcoR1 реже само когато срещне ГААГТЦ. Тази последователност се среща на определено място в генома, но в резултат на мутация някои индивиди може да имат вариант на въпросния сегмент, например ГААТТЦ. Ензимът ще бъде в състояние да срязва само непроменените последователности, а не променените им варианти.) Това са естествено срещащи се разлики в ДНК последователността; срещат се най-често в лошата ДНК и това не се отразява върху функционирането на организма. По дължината на генома има буквално милиони от тях.
През първите месеци след срещата в Алта, Ботщейн, Дейвис и Сколник, заедно с Рей Уайт, по това време в Масачузетския университет, следват концепцията за ОДФП. През 1980 година роденият от това сътрудничество доклад провъзгласява новата ера в молекулярната човешка генетика. Те очертават ясен план за използването на ОДФП и изчисляват колко такива ще бъдат необходими, за да сме сигурни, че всяка точка от човешкия геном се намира в разумна близост с поне един ОДФП маркер — условия, принципно позволяващи да се картографира целият геном. Това е като на картата на Съединените щати да са отбелязани достатъчно градове, за да може местоположението на всяко неотбелязано място да се определи доста точно, като се използва единствено информацията за близостта му с означените градове. Какво обаче е „разумна близост“ за генетичната карта? Ботщейн и неговите колеги изчисляват, че са достатъчни 150 ОДФП, стига да са разпределени равномерно по дължината на целия човешки геном. Първата полза от системата е новата стратегия за идентифициране на причиняващите болести гени. Изследването се прави върху семейства, при които дадена болест се проявява няколко поколения, като се вземат ДНК проби както от засегнатите, така и от незасегнатите им членове. После, като се използват рекомбинантни методи, се тестват един след друг ОДФП и се търсят тези, които дават възможност да се проследи предаването на болестта в семейството.
 Генетично картиране на причиняващ болест ген. За удобство са показани само две поколения и няколко човека. За да бъде статистически валиден, анализът трябва да обхваща голям брой хора с роднинска връзка.
Генетично картиране на причиняващ болест ген. За удобство са показани само две поколения и няколко човека. За да бъде статистически валиден, анализът трябва да обхваща голям брой хора с роднинска връзка.
През 1979 година, преди публикуването на въпросния труд, Уайт представя тези идеи на една конференция, проведена в лабораторията в Колд Спринг Харбър. Той отбелязва, че сред „най-големите пуристи в молекулярната биология това предизвиква голямо недоволство“. Изразен е значителен скептицизъм, че методът изобщо ще проработи; но дори тези, според които ще проработи, не са единодушни по въпроса кой е най-добрият начин да бъде използван. Тези несъгласия излизат наяве при проведената по-късно среща, посветена на обсъждането как ОДФП анализ на свързването би могъл да се използва, за да бъде открит генът, отговорен за болестта на Хънтингтън. Нанси Уекслър иска нейните генеалогични дървета на обитателите на бреговете на езеро Маракайбо да бъдат подложени веднага на анализ на свързването, но според Ботщейн и Уайт е твърде рано ОДФП анализ на свързването да се използва за търсенето на гена на болестта на Хънтингтън или която и да е друга болест. В крайна сметка решимостта на Уекслър води до разделение: фондация „Вродени заболявания“ настоява да се започне издирване на гена на болестта на Хънтингтън, Ботщейн и Уайт оказват натиск да се направи пълна карта на човешкия геном.
Втората цел изисква да се открият ОДФП маркери на всяка хромозома и то достатъчен брой, за да бъде поне един близо до всяка точка в генома. Скоро се налага да се прегледа първоначално определената приблизителна цифра 150. Междувременно научни лаборатории, като тази на Уайт, започват да изолират ОДФП и скоро се задейства и комерсиалната биотехнология.
През 1983 година Хелън Донис-Келър, опитен молекулярен биолог и по това време съпруга на Дейвид Ботщейн, създава отдел по човешка генетика към корпорация „Съвместно сътрудничество“, действаща в региона на Бостън компания. Целта й е произвеждането на ОДФП свързваща карта на целия човешки геном, с достатъчно маркери, за да могат да се локализират гените на болестите в която и да е хромозома. Плодът на тези усилия е публикуван четири години по-късно в доклада съвсем уместно наречен: „Карта на генетичните връзки в човешкия геном“. Картата включва 403 участъка, много повече от първоначалното предположение на Ботщейн, а пресмятанията показват, че 95% от генома е на разумно разстояние (или „свързано“) от даден маркер. Това е велик ден за картирането на генома, но през 1987 година между изследователите отново възникват раздори и съперничество.
Първо, сред академичните среди цари недоволство, че корпорация „Съвместно сътрудничество“ използва получената безплатно от университетските лаборатории информация, но не споделя нито един от откритите от нея факти. (В това отношение корпорация „Съвместно сътрудничество“ е пионер в прилагането на стратегията, от която по-късно ще се възползват Крейг Вентър и други, когато се стигне до секвенционирането на човешкия геном.) Френският имунолог Жан Досе например, върви по малко по-различен път. Нобеловата му награда по физиология или медицина за 1980 година привлича вниманието на великодушен благодетел, чието значително дарение дава възможност на Досе да следва своята стратегия при изготвянето на карта на генетичните връзки. Той осъзнава, че работата ще се улесни значително, ако всички изследователи по света работят със стандартен набор от генеалогични дървета — ДНК проби от едни и същи фамилии. И така, Досе създава в Париж Център за изучаване на полиморфизма при човека, за събирането на генеалогична информация, оптимална за генетичен анализ: големи семейства с три живи поколения, от които да се вземат проби. Постепенно Центърът за изучаване на полиморфизма при човека събира колекция, съдържаща ДНК от шейсет и едно семейства, сред които много от изучаваните от Рей Уайт мормонски фамилии, семействата от езерото Маракайбо на Нанси Уекслър и каталогизираните от Виктор Маккузик от Медицинското училище „Джон Хопкинс“ амишки семейства. Центърът за изучаване на полиморфизма при човека прави ДНК пробите от всички тези фамилии безплатно достъпни за изследователите с единственото условие след това да дадат резултатите от своите анализи на Центъра, за да бъдат вкарани в световната база данни. Корпорация „Съвместно сътрудничество“ се възползва максимално от този източник.
Най-сериозната критика срещу картата на „Съвместно сътрудничество“ е неравномерното разпределение на маркерите. Хромозома 7, свързана с кистозната фиброза — една от целите на „Съвместно сътрудничество“ — има 63 маркера, докато по хромозома 14 са идентифицирани само 6. Разстоянието между маркерите на бедните на маркери хромозоми е значително по-голямо, отколкото средното за генома като цяло. Рей Уайт е особено разстроен от претенциите на „Съвместно сътрудничество“. Той самият е открил над 470 маркера, но публикува своята информация хромозома по хромозома, след като всяка бъде запълнена с необходимата плътност от ОДФП. „Никога не бихме си и помислили да направим подобна публикация с нашия набор от информация, който е значително по-богат от техния, защото все още има празнини“ — отбелязва той, отхвърляйки грандиозните претенции на „Съвместно сътрудничество“. Независимо дали претенциите са грандиозни или не, обаче, картата на „Съвместно сътрудничество“ доказва, че картирането на целия геном е напълно възможно и представлява значителен напредък.
Но, както отбелязахме, някои, като Нанси Уекслър, виждат как публикуваният през 1980 година доклад за ОДФП отваря пред нас и други перспективи. Когато усилията за създаването на разбираема карта набират скорост, Дейвид Хаусман от Масачузетския технологичен институт, се насочва към цел, която е обявена от Дейвид Ботщейн за „невъзможна мисия“ на този стадий на играта: да открие местонахождението на гена на болестта на Хънтингтън. Той поверява тази отговорна задача в ръцете на Джим Гюзела, току-що защитил докторската си дисертация в лабораторията на Хаусман. Работата по картирането открива още един фронт.
Първоначалният песимизъм на Ботщейн е породен от липсата на маркери: ОДФП изглеждат добре на хартия, но работата по тяхното набиране тепърва започва. И наистина, ще бъдат необходими многогодишни усилия от страна на Уайт, Донис-Келър и други, докато броят на известните маркери достигне неколкостотин. Работата, която Гюзела започва в зората на епохата на ОДФП, е създадена като че ли специално по негов вкус. През 1982 година той разполага всичко на всичко само с дванайсет маркера, пет, открити от самия него и седем — от други. Междувременно Уекслър се връща отново на брега на Маракайбо, за да се заеме с подробностите на своите генеалогични дървета: кой за кого е бил женен, какви деца е имал, кой на кого е братовчед. Местният обичай понякога създава пречки: някои имена са извънредно разпространени, а доста от хората са известни с повече от едно име. Дървото, което Уекслър успява да състави за едно семейство, съдържа 17 000 имена! Периодично тя и нейните колеги отделят по един ден за вземането на кръв; всички проби трябва да се изпращат до Бостън, иначе тропическите жеги около езерото Маракайбо ще ускорят разлагането на ДНК.
Колкото до Гюзела, той не чака пробите от езерото Маракайбо. Спомням си срещата в лабораторията в Колд Спринг Харбър през октомври 1982 година, на която той представи първите получени факти. Опирайки се върху пробите, взети от малко, засегнато от болестта на Хънтингтън семейство от Айова, той тествал само пет от своите дванайсет ОДФП, за да провери дали някой от тях не е свързан с въпросното заболяване. Никой не беше свързан и нямаше как да не ми мине през ума, че, след като се бе заел да търси игла в купа сено, той не бе направил кой знае колко повече от това да вдигне няколко сламки. Единствено чрез внимателен анализ на цялата купа сено, тоест на целия геном в неговата цялостност, или ако има голям късмет, човек можеше да се надява да намери това, което търсеше Гюзела. И когато в заключение той заяви, че откриването на гена на болестта на Хънтингтън вече е само въпрос на време, аз си казах: „Да, на много дълго време“.
Но късметът обича смелите. След като се връща в лабораторията си, Гюзела се заема с други ОДФП маркери. За негово учудване дванайсетият, наречен G8, като че ли е свързан с болестта на Хънтингтън в семейството от Айова. Статистическата корелация обаче не е много силна. Затова той очаква с нетърпение проби от езерото Маракайбо и веднага след като ги получава, ги тества за G8. Сега вече възбудата е неудържима: болестта на Хънтингтън действително е свързана с G8. До лятото на 1983 година, колкото и невероятно да изглежда, Гюзела открива връзката, след като пробва само дванайсет ОДФП. Но това не е обикновен късмет: за първи път върху хромозомата е локализиран генът на дадена болест без помощта на връзката с пола и без никакви предварителни познания за биохимическата основа на болестта. Внезапно се разтварят нови научни перспективи: изглежда най-после щяхме да сме в състояние да анализираме из основи генетичните дефекти, които преследваха вида ни откакто съществуваше. ОДФП бе доказал ефективността си. А след като генът на болестта на Хънтингтън бе локализиран върху даващ възможности да бъде контролиран участък от човешкия геном, със сигурност бе въпрос единствено на време, преди мощните ни техники за генно клониране да доведат до изолирането на самия ген.
Болестта на Хънтингтън нанася ужасния си удар в зряла възраст. Но генетичните болести, поразяващи в детството, са дори още по-ужасни, защото засягат създанията, които още не са имали възможност да живеят. Въз основа на поставената диагноза често сме в състояние да предвидим с мрачна сигурност как ще протече животът на детето. Такъв е случаят с мускулната дистрофия на Дюшен — прогресивно, увреждащо мускулите заболяване, свързано с пола: отговорната за неговото възникване мутация засяга ген, носен от X хромозомата. Възможно е жената да носи мутацията на една от двете си X хромозоми, но обикновено е защитена от наличието на нормален вариант на гена върху другата си X хромозома. Твърде малко вероятно е да наследи две дефектни копия, защото носещите мутация представители на мъжкия пол почти никога не доживяват възраст, която да им позволи да станат бащи. Но ако хромозомата с мутиралия ген се предаде на син, момчето заболява от мускулната дистрофия на Дюшен, тъй като няма друга X хромозома, която да му осигури нормално копие на гена. Около петата му година родителите ще забележат, че му е трудно да става от пода или да изкачва стълби. Към десетата си година вече ще се нуждае от инвалидна количка. И най-вероятно ще умре в края на юношеството или на двайсет и няколко години. Мускулната дистрофия на Дюшен не е рядкост; тя застига 1 на всеки 5 000 момчета.
Търсенето на гените, причиняващи болести, се доминира в по-малка степен от големите изследователски институции и смелите предприемачи, отколкото от групи като фондация „Вродени заболявания“, организации, основавани от хора, изпитали лично ужаса, който може да причини едно или друго наследствено заболяване. Водени от хора, за които залогът е нещо безценно, тези групи са по-склонни да подкрепят рисковани или новаторски изследвания, неща, с които университетите или биотехнологичните компании се страхуват да се заемат.
Американската асоциация за мускулна дистрофия и подобните на нея в Европа отдавна подкрепят лабораторните изследвания, насочени към разбирането на биологията в основата на мускулната дистрофия на Дюшен. В края на седемдесетте години цитогенетиците (които изследват хромозомите с микроскоп), подсказват първите генетични ключове. Сред съвсем малкия брой момичета, които развиват мускулната дистрофия на Дюшен, е открита анормалност в късата издатина на X хромозомата, на мястото, наречено Xp21. Възможно ли е там да е местоположението на гена на мускулната дистрофия на Дюшен?
Скоро след това Боб Уилямсън от Медицинското училище към болницата „Сейнт Мери“ в Лондон поставя началото на базиращи се върху ОДФП изследвания на гените за кистозната фиброза и мускулната дистрофия на Дюшен. Колежката му Кей Дейвис изнамира ОДФП върху X хромозомата и ги тества за евентуална връзка с мускулната дистрофия на Дюшен. Усилията й се увенчават с успех и неоспоримият им аргумент е местоположението: те се намират в участъка на Xp21, както може да се очаква, като се имат предвид странните X хромозоми на жените с мускулна дистрофия на Дюшен.
Докато ловците на гени напредват, опитвайки се да изолират гените, причиняващи болестта на Хънтингтън и мускулната дистрофия на Дюшен, в офисите на клиничните генетици се извършва една по-тиха революция. От самото начало Нанси Уекслър и Дейвид Хаусман си дават сметка, че ОДФП, свързани с гена на дадена болест, могат да се използват не само за локализиране на самия ген, но и за диагностично тестване с цел да се определи кои членове от дадено семейство носят мутацията. С тях може да се тестват даже още неродените деца. Да си представим семейство, генетично обременено от мускулната дистрофия на Дюшен. Поне едно момче ще бъде диагностицирано като носител на мутацията, причиняваща заболяването. Неговата майка, носителката на мутиралия ген, има и едно нормално копие. Сестрите му може също да бъдат носителки и следователно, родените от тях синове са изложени на риск. Да предположим сега, че майката забременява отново и плодът е от мъжки пол; вероятността вторият син да бъде засегнат е 50%. Но, благодарение на ОДФП, лекарят ще може да й каже каква съдба очаква този плод, ако бъде износен и роден.
Първо се анализира X хромозомата на засегнатия син, за да се идентифицират конкретните ОДФП, свързани с гена на мускулната дистрофия на Дюшен в семейството. След това се взема ДНК от зародиша или проба от плацентата, или околоплодна течност, която съдържа клетки от зародиша. Ако ОДФП на зародиша съвпадат с ОДФП на засегнатото момче, тогава можем да бъдем почти сигурни, че и нероденото дете ще бъде засегнато. Защо само „почти“ сигурни? Както видяхме в Първа глава, при производството на яйцеклетките хромозомните двойки се подлагат на рекомбинация, разменяйки ДНК: двете копия на хромозома 1 правят размяна, както и двете копия на хромозома 2, двете копия на X хромозомата и тъй нататък. Ако тази размяна стане на място в X хромозомата, намиращо се между ОДФП маркерите и гена на мускулната дистрофия на Дюшен, ОДФП, които е установено, че се свързват с нормалния вариант, е възможно да се свържат с мутиралото (причиняващо мускулна дистрофия на Дюшен) копие. Опитът показва, че с първите ОДФП за мускулната дистрофия на Дюшен това става при около 5% от случаите, следователно базираното върху ОДФП диагностициране има само 95% вероятност да бъде точно. Тази степен на неточност е неизбежно последствие от рекомбинацията. Затова, макар подобно диагностициране да е огромен напредък, абсолютната сигурност зависи от идентифицирането на самия ген, а не просто на свързаните с него маркери.
Ключът към изолирането на гена на мускулната дистрофия на Дюшен е момченцето Брук Брайър; от късия издатък на неговата X хромозома липсва значителна част. Липсващият участък е толкова голям, че Брус страда освен от мускулната дистрофия на Дюшен, от още три вродени заболявания. През 1985 година Лу Кънкел от Харвардското медицинско училище решава да опита да използва ДНК на Брус, за да „излови“ нормалния ген от ДНК на незасегнато от болестите момче. Случаят на Брус е специален, защото болестта е причинена не от дефектно копие на гена, а от пълната му липса. Кънкел осъзнава, че в едно нормално момче би трябвало да присъства цялата ДНК на Брус и ключът е в последователностите, които липсват в Брус, а присъстват само в другото момче. С помощта на рекомбинантни методи, Кънкел изважда ДНК на Брус от нормална ДНК и запазва разликата — ДНК, където би трябвало да се намира генът на мускулната дистрофия на Дюшен. Макар изваждането да не се осъществява безупречно, той все пак успява да открие желаните части ДНК, използвайки генетични маркери, свързани с участъка Xp21.
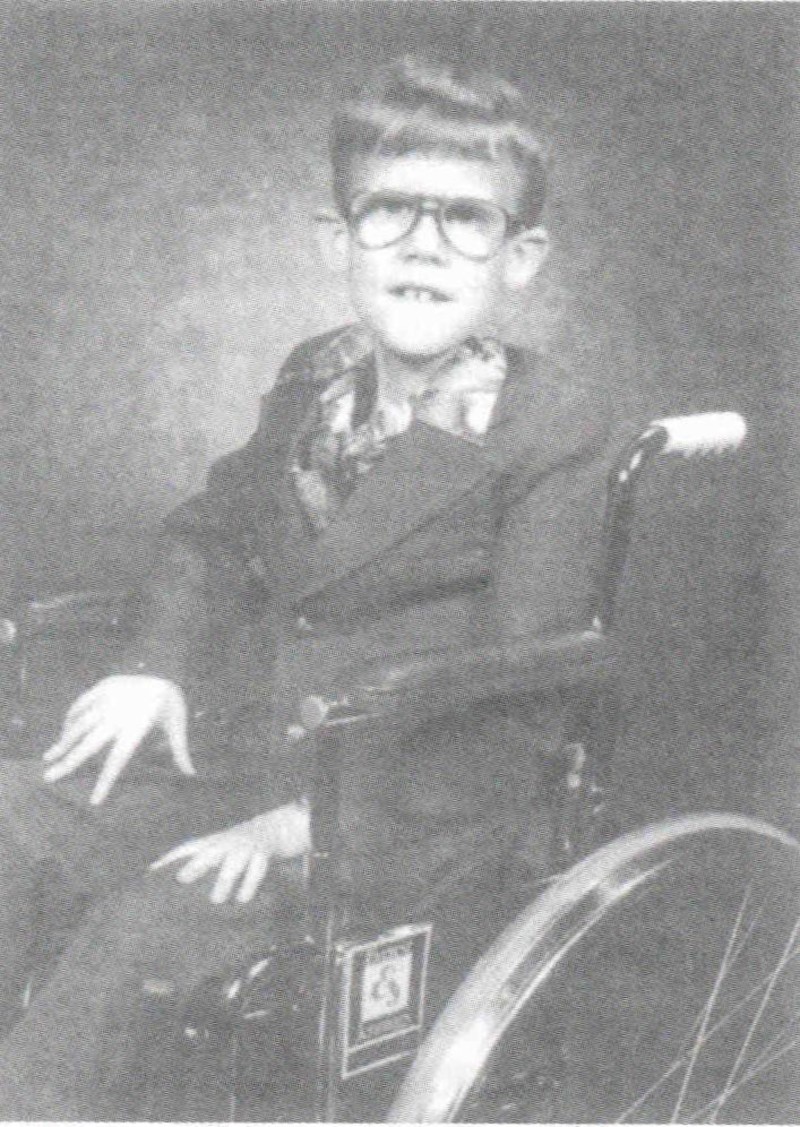 Брус Брайър, чиито липсващи участъци в X хромозомата доведоха до идентифицирането на гена на мускулната дистрофия на Дюшен. Той успява да води забележително нормален живот и става превъзходен органист, но умира на седемнайсет години вследствие на автомобилна катастрофа.
Брус Брайър, чиито липсващи участъци в X хромозомата доведоха до идентифицирането на гена на мускулната дистрофия на Дюшен. Той успява да води забележително нормален живот и става превъзходен органист, но умира на седемнайсет години вследствие на автомобилна катастрофа.
Тони Монако, специализант при Кънкел, се заема да определи кои от тези парчета Xp21 от ДНК може да са част от гена на мускулната дистрофия на Дюшен. Единственият начин да се направи това е като се сравнява всяка част ДНК с ДНК на няколко страдащи от мускулна дистрофия на Дюшен пациенти, които не са в роднински връзки. Монако успява при осмия опит: оказва се, че последователността, наречена pERT87, липсва при пет от неговите момчета с мускулна дистрофия на Дюшен. Монако започва да изолира други, близки до pERT87 последователности; оказва се, че те също липсват в ДНК на пациентите с мускулна дистрофия на Дюшен. До 1987 година групата на Кънкел изолира целия ген. Той получава напълно подходящо за случая име: дистрофин. Дори сега, след като целият геном е завършен, той си остава най-дългият ген в човешкия геном, най-вече заради множеството си големи интрони.
Новите знания се прилагат незабавно за извършването на сигурно предродово диагностициране за мускулна дистрофия на Дюшен. Скоро учените откриват, че цяла поредица различни мутации са в състояние да увредят дистрофина и да причинят заболяване. Но остава неясно какво точно прави всъщност генът. Дали функцията му ще ни даде ключ към разработването на ефикасни терапии за мускулната дистрофия на Дюшен?
Първата стъпка е локализирането на протеина, произвеждан от гена в мускулните клетки. Ерик Хофман в лабораторията на Лу Кънкел открива, че протеинът дистрофин обикновено се намира в мускулните клетки непосредствено под мембраната, ограждаща мускулните влакна. По-нататъшните изследвания разкриват изключително важната роля на дистрофина при свързването на белтъците, изграждащи вътрешната архитектура на клетката, с молекулите, изтъкаващи клетъчната мембрана и взаимодействащи с други протеини извън клетката. Свързването на вътрешните молекули с молекулите в мембраната по някакъв начин укрепва клетъчната мембрана, когато мускулите се свиват и отпускат. Без дистрофина мембраната се уврежда и мускулът умира клетка по клетка. Може би изглежда невероятно, че въпреки всичките си нови детайлни познания за дистрофина и неговите функции, все още няма лекарство за мускулната дистрофия на Дюшен. Това е главната причина за чувството на неудовлетвореност при съвременното състояние на изкуството на генетиката: тя направи възможно идентифицирането и разбирането на болестите, но в повечето случаи все още не позволява наследствената грешка да бъде поправена.
Подходът на Кънкел е в духа на съвременния, базиращ се върху картирането подход за правене на дисекция на дадено заболяване. Макар сега този метод да е масова практика, когато Кънкел го прилага, той е толкова далеч от ортодоксалните изследователски разбирания, че Асоциацията по мускулна дистрофия поема голям риск, като подкрепя четиригодишните му усилия и е подобаващо възнаградена за това. Някога биохимическият анализ се използваше за анализиране симптомите на дадено заболяване с цел идентифициране гена на болестта; днес, следвайки метода на Кънкел, генът се картира и след това симптомите се интерпретират в светлината на функцията на гена.
Един от най-силните доводи в полза на картиращия подход бе, че работата бе от полза дори преди окончателното идентифициране на гена. Търсенето на гените, отговорни за болестта на Хънтингтън и мускулната дистрофия на Дюшен снабди науката с генетични маркери, които можеха да се прилагат за диагностициране още преди откриването на самите гени. Същото беше положението и с едно от най-често срещаните генетични заболявания — кистозната фиброза. Търсенето на гена на кистозната фиброза се прочува особено поради две причини: то бележи първия случай, при който компания се включва в картирането на болестотворен човешки ген и първия случай на брутална конкуренция между учените, участващи в подобно начинание.
При пациентите с кистозна фиброза в белите дробове се събира гъста слуз и затруднява дишането. Клетките, образуващи лигавицата на тръбите на белите дробове, не могат да изчистват слузта, в която бактериите се развиват прекрасно и предизвикват белодробни инфекции. Преди създаването на антибиотиците засегнатите от това заболяване рядко доживяваха над десетгодишна възраст; днес шансовете им да поживеят повече са значително по-добри. Кистозната фиброза е едно от най-разпространените наследствени заболявания, поразяващо 1 от 2 500 човека от северноевропейски произход. Наследяването й става по рецесивен модел: нужни са два мутирали варианта на гена. Но тъй като 1 на 25 човека от Северна Европа носят един мутирал вариант (макар самите те да са предпазени, тъй като имат и едно нормално копие), съществува сравнително голяма вероятност двама носители да създадат поколение и да предадат и двамата точно мутиралия вариант на едно или повече от децата си. Следователно един от приоритетите е да се създаде диагностичен тест веднага, щом подобна цел стане реалистична.
Роден в Шанхай и следвал в Хонконг, Лап Чи Цуи пристига в Съединените щати като специализант през 1974 година. Цуи се специализира в областта на молекулярната генетика, като изследва вируси, преди да се премести в лабораторията на Мануел Бъкуолд в Торонто през 1981 година, за да работи върху кистозната фиброза. Този тих и любезен човек преследва със завиден плам целите си. Решил да открие гена чрез ОДФП анализа на взаимовръзките, той посвещава първите две години на откриване на семейства с кистозна фиброза, преди да се заеме с трудоемката задача да сравнява тяхната ДНК с всеки ОДФП, до който успее да се добере. Но късметът, който се усмихва на Джим Гюзела при търсенето на гена на болестта на Хънтингтън, не спохожда и Цуи: след едногодишни усилия той успява единствено да елиминира множество ОДФП. И е щастлив, когато „Съвместно сътрудничество“ му предлага да използва ОДФП маркерите на корпорацията.
Торонтската група на Цуи не е единствената, тръгнала по следите на гена на кистозната фиброза; същото правят и Боб Уилямсън в Лондон, работил върху мускулната дистрофия на Дюшен, и Рей Уайт, по това време в Юта, привлечени от достъпа до богатата колекция от генеалогични дървета, събрана от църквата на мормоните. Тази документация, Досието на предците, позволява на днешните членове на църквата да направят нещо за душите на своите предци, живели извън лоното на църквата или починали преди нейното учредяване през 1830 година. Целта е събирането на семействата за вечни времена. Рядко нуждите на религията и генетиката са били така синхронни.
В крайна сметка първият успех бележи групата в Торонто, когато през 1985 година открива връзка между един от ОДФП на „Съвместно сътрудничество“ и гена на кистозната фиброза. По това време местоположението на въпросния ОДФП е неизвестно, но виждайки в него потенциално златно яйце, „Съвместно сътрудничество“ се заема незабавно с неговото установяване. И скоро открива, че се намира на хромозома 7, но не информира веднага своя сътрудник Цуи за находката си. Нито пък споменава за локализирането върху хромозома в броя от 22 ноември на престижното си списание „Сайънс“. Очевидно опитва да запази монопола си върху информацията, но потайност и наука често не се спогаждат: скоро се разчува, че търсеното място е върху хромозома 7.
Докато „Съвместно сътрудничество“ пази мълчание по въпроса, само дни делят Уилямсън и Уайт от тяхното откритие. И в двата им доклада, публикувани в „Нейчър“ — британският съперник на „Сайънс“ — се споменава, че ключовите ОДФП са в хромозома 7. Цуи е вбесен — на път е да се лиши от претенциите си за откриване на връзката благодарение на номерата на своите партньори — в науката няма награди за финиширалия втори — но Хелън Донис-Келър убеждава „Нейчър“ да приеме доклад от екипа Торонто — „Съвместно сътрудничество“, обявяващ местонахождението. И така трите доклада се появяват в броя на „Нейчър“ от 28 ноември заедно с обяснение на редактора как се е стигнало до това.
Партньорството между Торонто и „Съвместно сътрудничество“ не издържа на сблъсъка на академичния и комерсиалния мироглед. „Съвместно сътрудничество“ открива, че научният свят започва да се опасява от сътрудничеството с корпорацията — положение, което се задълбочава в резултат на глупавото и не особено издържано твърдение, направено от главния изпълнителен директор на „Съвместно сътрудничество“ Ори Фридман, че „ние притежаваме хромозома 7“. За щастие краят на тази сапунена опера настъпва през декември 1985 година, когато всички изследователски групи се договарят да съберат на едно място своите ресурси, за да тестват 211 семейства за връзки с ОДФП на хромозома 7. Резултатите са забележителни. ОДФП са много близки до гена, в рамките на 1 000 000 базови двойки, което ги прави полезни при диагностицирането, една от главните цели при изследването на кистозната фиброза.
Следващата стъпка обещава да е дори още по-трудна. По-добре е да знаеш, че Ню Йорк се намира някъде по средата между Вашингтон и Бостън, отколкото да си информиран единствено, че е разположен някъде в Съединените щати. Но ако трябва да тръгнеш пеш по пътя от Вашингтон за Бостън и да се взираш метър след метър за надписа „Добре дошли в Ню Йорк“, този ключ вероятно няма да ти се стори чак толкова полезен. Един милион базови двойки може и да са близо по стандартите на анализа на свързването, но е много дълъг път за клониращите гени, които анализират участъците базова двойка по базова двойка. За да измине разстоянието от двата ОДФП, най-близки до гена на кистозната фиброза, Цуи обединява усилията си с Франсис Колинс, който по това време е в Мичиганския университет и по-късно ще наследи от мен директорския пост на Проекта за изследване на човешкия геном.
Колинс разработва „прескачащи“ техники за улесняване клонирането на даден ген между двойка известни ОДФП, но и той като Цуи не си прави илюзии за проблемите, които ги очакват. След двугодишна работа те успяват да локализират гена на кистозната фиброза в участъка ДНК край 280 000 базова двойка; в него откриват последователност от ген, за който се знае, че играе важна роля в човешките потни жлези, които са дисфункционални при пациентите с кистозна фиброза. По всичко личи, че пълният ген, причиняващ това заболяване, е на път да бъде открит.
Единственият начин да се уверят, че са прави, е да секвенционират ДНК копия и да търсят причиняващите болестта мутации. Това е голямо предизвикателство през 1989 година, защото участъкът е дълъг 6 500 базови двойки, и трябва да се направи два пъти: веднъж с ДНК на пациент с кистозна фиброза и още веднъж — с ДНК на здрав индивид. Резултатът обаче е напълно ясен: в ДНК на заболелия липсва отрязък от три базови двойки, водещ до липсата на само една аминокиселина в протеина. Тази мутация е отговорна за около 70% от случаите на кистозна фиброза, но в гена на кистозната фиброза са открити още повече от хиляда други мутации, също причиняващи заболяването на човека. Тази множественост на вредни варианти затруднява извънредно много работата по диагностицирането въз основа на ДНК.
Нека сега се върнем към Нанси Уекслър, Дейвид Хаусман, Джим Гюзела и техните колеги, които изоставихме през 1983 година в момента им на триумф, когато конкретен ОДФП, G8, се свързва с гена за болестта на Хънтингтън. И ако тогава изглеждаше, че бяха имали невероятен късмет при учудващо бързото локализиране на гена на болестта на Хънтингтън, боговете скоро решиха да възстановят равновесието. Откриването на гена бе отнело едва три години; изолирането му за подробен анализ щеше да отнеме десет години на международен екип от 150 учени. В този случай участъкът, в който бе локализиран генът, имаше дължина 4 000 000 базови двойки. Генетиците се стараеха да намалят потенциалните възможности, но генетичното картиране става толкова по-трудно, колкото повече се скъсява генетичното разстояние, и в крайна сметка тези усилия бяха възнаградени с доста двусмислени факти. Да си представим отново пътуването пеш от Вашингтон за Бостън, в търсене на Ню Йорк. Сега да си представим, че се озоваваме на едно кръстовище във Филаделфия и според поставения там пътен знак към Ню Йорк водят две посоки.
Противоречивият анализ на свързването кара „ловците“ на гена на болестта на Хънтингтън да измислят алтернативна стратегия — да се фокусират върху почти еднаквия у всички пациенти с болест на Хънтингтън участък. Този подход в крайна сметка намалява участъка само до 500 000 базови двойки и настава време да се обърнат към техниките за генно клониране. Първите резултати са разочароващи: откриват три гена в дясната половина на участъка, но нито един от тях не проявява аномални признаци при пациентите с болест на Хънтингтън. Без да се отчайват, те изследват и лявата половина и откриват един-единствен ген с прозаичното име IT15. Най-сетне, след десет години и много непечеливши лотарийни билети, късметът започва да им се усмихва отново. Генът съдържа една кратка последователност, ЦАГ, повтаряща се многократно като късите свързани повторения (КСП), използвани при ДНК отпечатъците. Оказва се, че здравите хора имат по-малко от 35 повторения на ЦАГ, докато хората с повече от 40 развиват болест на Хънтингтън като възрастни; в редките случаи на повече от 60 повторения, преди двайсетата година се развива тежка форма на болест на Хънтингтън. ЦАГ е генетичният код за аминокиселината глутамин, така че всяко ЦАГ добавя допълнителен глутамин към белтъка. В случая със страдащите от болестта на Хънтингтън, кодираният от гена на тази болест протеин, трудният за произнасяне Хънтингтън, съдържа допълнителни глутамини. Тази разлика явно влияе върху поведението на белтъка в клетките на главния мозък, като вероятно кара молекулите да се слепват на топчици вътре в клетката и по някакъв начин причиняват смъртта й.
Тези резултати бяха постигнати вследствие огромни усилия от страна на всички лаборатории от екипа на фондация „Вродени заболявания“ и, като признание, че това е действително плод на съвместно сътрудничество, единственото име, появило се като автор на статията, е Група за съвместно изследване на болестта на Хънтингтън. Вече бе установено, че същият странен тип мутация — повторения на последователността от трите базови двойки — е свързан и с други три болести, също от неврологичен тип. Вече са ни известни четиринайсет от тези „нарушения при тринуклеотидни повторения“, но все още не сме се доближили до обяснението защо главният мозък е толкова уязвим от този тип мутация.
Може би е депресиращо да се знае, че макар откриването на гените на болестта на Хънтингтън, на мускулната дистрофия на Дюшен и на кистозната фиброза да отне доста време, според стандартите на генетиците тези болести са „прости“. Те се причиняват от мутации в един ген и не се влияят особено от околната среда. Ако някой има повече от 40 повторения в един от гените си за болестта на Хънтингтън или му липсват трите базови двойки и в двата гена за кистозна фиброза, той би развил тези болести, независимо къде живее или какво яде или пие. Съществуват голям брой болести с един ген, няколко хиляди според информацията, с която разполагаме засега, но голямата част са извънредно редки и се срещат само при няколко семейства.
Много по-разпространени са „сложните“ или „полигенни“ болести, сред които са най-разпространените ни заболявания: астма, шизофрения, депресия, вродени сърдечни заболявания, високо кръвно налягане, диабет и рак. Те се причиняват от взаимодействието на няколко, може би — много гени, всеки един от които самостоятелно има съвсем слаб или дори незабележим ефект. И, типично за полигенните заболявания, има още едно усложнение: тези комплекти от взаимодействащи си гени са в състояние да създадат предразположение към определено заболяване, но дали в крайна сметка ще се прояви, зависи от околната среда. Да предположим, че някой има поредица генни варианти, които го предразполагат към алкохолизъм. Дали този човек ще се превърне в алкохолик, зависи от това дали съответният възбудител — в случая алкохолът, присъства в неговото обкръжение. Съдбата му може да бъде съвсем различна, в зависимост от това дали е израснал в Тексас или в Манхатън. Същият принцип важи и за астмата: при „добро“ лято, когато концентрацията на полен и спори е ниска, може да не се появят симптоми, макар човек генетично да е предразположен към заболяването.
Сложната игра на гените и околната среда никъде не е така очевидна както при рака. Ракът е генетично заболяване, причинено от мутации в няколко гена. Всяка мутация променя още един елемент в поведението на клетката, докато тя придобие всички характеристики на напълно злокачествена клетка. Раковите мутации се пораждат по два начина. Някои видове рак са действително наследствени. Но, за огромно съжаление, болестта е толкова разпространена, че не е рядко в едно семейство да има два или дори три случая на заболяване от нея, без наличието на наследствен компонент. (Изучаващите „раковите семейства“ генетици прилагат изключително строги критерии, когато определят дали даден рак е наследен.) Много ракови мутации се пораждат по време на самия живот. ДНК може да се увреди в резултат на грешки, допуснати от ензимите при умножаването или възстановяването на генетичната молекула или вследствие на странични ефекти от нормалните химически реакции, извършвани в клетката. Много видове рак възникват благодарение на собствената ни глупост. Ултравиолетовите лъчи в слънчевата светлина са мощни мутагенни агенти, на които любителите на слънцето се излагат доброволно, а цигарите са извънредно ефикасен начин за доставяне на канцерогени право в белите дробове, където причиняват рак. Установено е, че други фактори от нашето обкръжение, например азбестът на работното място, също спомагат за появата на рак. Изводът от всичко това е, че ДНК може да се увреди и по естествен път, но от нас зависи да сведем до минимум тези увреждания, като правим информиран личен и обществен избор.
През 1974 година Мери-Клер Кинг (както вече стана дума прочула се покрай хора, шимпанзета и Las Abuelas), се премества в лаборатория в Калифорнийския университет в Сан Франциско, изследващ рака на гърдата, решила да се посвети на търсенето на причиняващия го ген. По това време до изнамирането на подхода ОДФП остават още цели шест години, но Кинг знае, че ключът се намира в родословното дърво, затова се заема да събира такава информация. Тя търси семейства, чиито членове са развили рак на гърдата в ранна възраст и в които има също така случаи на рак на яйчниците, смятайки, че всичко това доказва вината на наследствения фактор в тези случаи. Единствените генетични маркери, до които има достъп тогава, са белтъчните маркери, и след няколко години тя публикува първия си доклад за рака на гърдата, описвайки неуспешните тестове за свързване с повърхностните клетъчни протеини. Той е последван от други доклади, свидетелстващи за също така отрицателни резултати. Според много от учените по това време ракът на гърдата се повлиява прекалено силно от факторите на околната среда, за да позволи генетичен анализ, и подобни търсения наподобяват прословутото дирене на игла в купа сено. Без да се обезсърчи, Кинг продължава да отсява информация и през 1988 година, след като е анализирала 1 579 семейства решава, че разполага с достатъчно доказателства за наличието на ген на рака на гърдата в тези рискови семейства.
Светът на медицината е силно учуден, когато през 1990 година тя съобщава, че е открила ОДФП в хромозома 17, свързан с рака на гърдата при 23 от нейните семейства, включващи 146 случая на рак на гърдата в рамките на три поколения. Кинг проверява за фактори, които биха могли да объркат анализа, например дали тези жени са били изложени на по-продължително облъчване с рентгенови лъчи или имат по-различни истории на бременността, но не намира опровергаваща получените факти информация. Тя открива, че мутацията на един ген, намиращ се в отсечката 17q21, излага жената на по-голям риск. Докладът й предизвиква надпревара за изолирането на самия ген, наречен „ген на рака на гърдата“ (BRCA1) и спорове за комерсиалното експлоатиране на гените.
Изолирането на гена BRCA1 несъмнено би било голямо събитие. Дори да е от значение само за малка част от рисковите семейства (тоест отговорен само за малка част от случаите на рак на гърдата), потенциалните прозрения, до които може да доведат познанията за гена, са достатъчен повод за вълнение. Кинг започва съвместна работа с Франсис Колинс, който е с безупречна репутация в областта на търсенето на гени, но двойката има солидна конкуренция. Марк Сколник, генетикът на популацията на Юта, участвал в пробива на ОДФП свързването, създава компанията Myriad Genetics с Уоли Гилбърт, чийто предприемачески дух оцелява след не особено приятните му преживявания на кормилото на Biogen. Бизнес планът на Myriad Genetics е да използва силата на родословните дървета на мормонските семейства, за да картира и клонира гени и BRCA1 се появява съвсем скоро във фокуса на тяхното полезрение. През 1994 година консорциум генетици от Myriad Genetics, Университета на Юта, Националните здравни институции, университета „Макджил“ и Eli Lilly обявяват пред света това, което доста сдържано наричат „солиден кандидат“ за гена BRCA1. Те действително са го открили. Всички участници кандидатстват за патент (въпреки че Myriad Genetics първоначално се погрижва учените от Националните здравни институции да бъдат изключени). През 1997 година е одобрена молбата на Myriad Genetics.
Докато BRCA1 се клонира, друг консорциум генетици, включително учени от Myriad Genetics и Института за изследване на рака в Англия съобщава, че са локализирали втори ген на рака на гърдата, BRCA2, на човешка хромозома 13. Започва поредното надбягване и преди да измине година, английската група заявява, че е успяла да изолира BRCA2. Те разбират, че са хванали плячката си, щом определят около две трети от ДНК последователността на гена и показват, че тя е дефектна при шест различни семейства. За да не позволи да бъде надмината, Myriad Genetics формира друг консорциум, този път включващ институти от Канада и Франция; скоро те публикуват цялата последователност на BRCA2, който се оказва доста голям ген. Разбира се, за патент кандидатстват както Myriad Genetics, така и Институтът за изследване на рака.
Ясно е, че това ще бъдат важни в комерсиално отношение гени. Техните мутации имат извънредно сериозни последствия за жените. Рискът дадена жена да развие рак на гърдата около седемдесетата си година поради мутирало копие на BRCA1 или BRCA2, може да бъде 80%. Установява се също така, че същите мутации увеличават риска от появата на рак на яйчниците до 45%. Жените, в чиито семейства вече има установени подобни мутации, трябва да бъдат информирани колкото е възможно по-рано, ако носят дефектен вариант на някой ген. Това им дава възможност за избор, който, колкото и да е труден, би могъл да им спаси живота: двустранна мастектомия при изложените на най-голям риск жени намалява вероятността от развиване на рак с 90%. Същевременно генетичното тестване е в състояние да установи кои членове на семейството имат нормални гени; това им носи огромното облекчение да знаят, че не са изложени на по-голям от средностатистическия риск.
По всичко изглежда, че целта е достойна за пазара: генетичен тест за едно извънредно сериозно заболяване, което би помогнало на жените да вземат информирани решения за своето здраве. Защо тогава Myriad Genetics често се превръща в пример за всички нередности, които възникват, когато търговията се свърже с науката? Myriad Genetics има вече девет патента в САЩ, покриващи BRCA1 и BRCA2, а през 2001 година получи един и в Европейската общност, един в Нова Зеландия, четири в Канада и два в Австралия. Всъщност сега компанията се радва на глобален монопол върху тези гени и световен контрол върху начина, по който се използват. Напълно в реда на нещата е Myriad Genetics да печели от тестването за мутациите на BRCA1 и BRCA2 — компанията оказва ценна услуга и е инвестирала големи средства за разработката на теста. Но колко би било разумно да печели? Днес всеки тест струва повече от 2 700 $. Същевременно Myriad Genetics ограничава опитите на академичните изследователи да използват последователности на гена BRCA за изработването на алтернативни тестове. А информацията за мутациите на BRCA, до която се достига чрез секвенционирането на ДНК на пациенти, привлечени за академични изследователски проекти, се задържа дори от самите пациенти; в противен случай това би било окачествено като диагностично-клинична употреба и оценено като използване без разрешение на патентите на Myriad Genetics.
В последно време Myriad Genetics направи някои отстъпки. Постигнатата от правителството договорка сега позволява учените, правещи изследвания, финансирани от Националните здравни институции, да използват теста срещу двойно по-ниската цена от 1 400 $. Но критиците не виждат в това нищо повече от символичен жест и не пестят протестите си, особено в Канада и Европа. Европейският парламент прие резолюция, изразяваща „смут“ от действията на Европейския патентен офис и инструктираща персонала на Парламента да подготви предизвикателства за патентите на Myriad Genetics и за двата гена. Френските партньори на Myriad Genetics в секвенционирането на BRCA2 — Институт „Кюри“ и Институт „Гюстав-Руси“ — са особено вбесени от патента на Myriad Genetics за BRCA2 и са подали съвместно оплакване до Европейския патентен офис. Във всеки случай монополът на Myriad Genetics най-вероятно няма да се отрази добре на пациентите. Тестът на компанията не успява да идентифицира всички евентуално причиняващи рак промени, засягащи гена, и хората, получили негативен резултат за определени мутации, може въпреки това да попадат в рисковата категория. Когато ви тества, Myriad Genetics ви дава да подпишете отказ от претенциите, че отрицателният резултат е гаранция за генетичното ви здраве. Разработването на по-изчерпателен тест е трудно поради технически причини, но повечето лаборатории по света, изследващи рака на гърдата, са готови да се заемат с тази задача веднага, ако не беше задушаващият всичко патент на Myriad Genetics.
През последните дванайсетина години, анализът на свързването бе използван и върху няколко други важни ракови гени, включително свързаните с неврофиброматозата (елефантиаза, която не се признава от всички за форма на рак), рака на дебелото черво и рака на простатата. Но макар и ефикасен, подходът ген-по-ген е бавен и трудоемък и всяко изследване зависи от изнамирането на подходящи за анализ семейства. Именно тук Проектът за изследване на човешкия геном ще докаже огромната си полза. Протеиновите и ДНК микроредици, с които се запознахме в Осма глава, ще снабдят ловците на ракови гени с мощно оръжие от голям калибър. Когато се заинтересувах за първи път от изследвания на рака през шейсетте години, знаехме толкова малко за лежащата в основата му генетика и разчитахме на такива първобитни средства, че се обърнах към вирусите, които причиняват рак при животните. Надявах се, че чрез изучаването на тези вируси (тъй като имат много малко гени, с тях бяхме в състояние да се справим дори тогава) може да достигнем до някои прозрения и за рака при хората. Днес изследванията на рака вече не се ограничават само с вирусите; в нашите възможности е да картираме и клонираме десетките хиляди гени в човешките тумори. Несравнимо богатство от познания ни очаква благодарение на откриването във все по-големи подробности на всички миниатюрни биохимически девиации, допринасящи за превръщането на нормалната клетка в ракова.
Повечето изследвания въз основа на анализа на свързването зависят от проследяването на определена генетична поредица в колкото се може повече поколения подред. Съществува обаче и друга стратегия, която се обръща към малки популации с голям процент случаи на дадено заболяване. Трудно би могла да се намери по-малка популация от тази в Тристан да Куня.
Тристан да Куня е вулканичен остров, издигащ се стръмно и негостоприемно над водата; това малко късче земя с площ само от четирийсет квадратни мили, се намира в южната част на Атлантическия океан и е едно от най-изолираните кътчета на планетата. Първите постоянни заселници са членовете на един британски гарнизон, създаден там през 1816 година, с цел да не позволи на французите да използват острова като база за измъкването на Наполеон от заточението му на остров Света Елена, който се намира на 1 200 мили северно. Населението нараства доста спорадично — там няколко заселници, тук няколко оцелели корабокрушенци, и в крайна сметка, според неофициално преброяване, населението през 1993 година наброява едва 301 човека. През същата година екип от Университета на Торонто, отива на острова, за да проследи медицинските изследвания на островитяните, започнати през 1961 година, когато цялата популация на острова е евакуирана в Англия поради временната активност на спящия вулкан на Тристан да Куня. Най-изненадващото откритие е, че около половината евакуирани имат астма.
Когато представителите на Торонтската Програма за генетиката на астмата изследват 282 от обитателите през 1993 година, се установява, че 161 (или 57%) проявяват едни или други симптоми на астма. Канадците изготвят генеалогични дървета на всички местни семейства; това не е особено трудно, защото всички островитяни са потомци на петнайсетината първи заселници и родословните им линии са тясно преплетени. Очевидно астмата се е появила на острова чрез две жени, заселили се там през 1827 година. Подобна популация е истински подарък за „ловците на гени“: островът е всъщност едно голямо семейство и следователно гените, причиняващи наблюдаваните заболявания, е най-вероятно да бъдат едни и същи в цялата популация — оптимален сценарий за анализа на свързването. При една по-голяма и смесена популация астмата на едни обикновено се причинява от един комплект гени, а на други — от друг комплект. Именно тази хетерогенност затруднява толкова идентифицирането на генетичните детерминанти.
Екипът от Торонто събира кръвни проби и подготвя ДНК, но се нуждае от още средства, за да продължи изследването. Именно тогава получава вест от Sequana — компания, създадена за изследване на гени на различни болести. Sequana финансира изследването и това незабавно поражда обвинения, че експлоатира островитяните, които може би не оценяват напълно своята роля в бизнес стратегията на Sequana. Канадски активисти, нарекли се „Фондация за международен провинциален напредък“, обвиняват Sequana в „извършването на биопиратски акт…, нарушавайки основните човешки права на хората, от които са взети пробите ДНК“. Sequana отвръща — и с това предизвиква още обвинения в „биопиратство“ — че е открила два гена, предизвикващи податливост към астма, но отказва да разкрие публично кои са те преди молбата й за европейски патент да бъде регистрирана. Гените са локализирани в хромозома 11 и последвалите изследвания на хетерогенни островни популации потвърждават ролята, която хромозома 11 играе при астмата. Така става ясно, че генетичните фактори, лежащи в основата на високия процент случаи на астма на Тристан да Куня, не са характерни единствено за изолираните обитатели на островите в Южния Атлантик.
 Една от най-отдалечените населени точки на планетата: Тристан да Куня, видян от близък безлюден остров.
Една от най-отдалечените населени точки на планетата: Тристан да Куня, видян от близък безлюден остров.
Бурята заради „биопиратството“ на Sequana е нищо в сравнение с урагана, който се разразява над Кери Стефансън и неговата компания deCODE Genetics няколко години по-късно. Давайки си сметка, че е досадно и неефикасно за всяко заболяване да се търсят микропопулации като тази на Тристан да Куня, Стефансън решава, че се нуждае от изолиран остров с много по-голямо население, сред чиито членове може да издирва едновременно гените на различни болести. По една случайност Кери Стефансън е роден на такъв остров.
Исландия е приблизително с размерите на Кентъки, но населението й е петнайсет пъти по-малобройно — 272 512 човека. Островът е заселен през IX и X век от викингите, които водят с тях пленените по време на пътуването ирландки. Исландия предлага няколко предимства на заелия се с издирване на гени. Първо, популацията е изключително хомогенна, състои се предимно от потомци на първите заселници; имиграцията от времето на викингите до наши дни е съвсем слаба. Второ, съществува подробна генеалогична информация за доста поколения; много исландци могат да проследят корените си до пет века назад. Тази безценна информация се допълва от подробното документиране на ражданията от 1840 година насам от Университета на Исландия. Трето, здравеопазването на Исландия е национализирано през 1914 година, така че медицинската документация на нацията е подредена и леснодостъпна… поне по принцип.
Харвардският невролог Стефансън се интересува от сложни в генетично отношение болести като множествена склероза и Алцхаймерова болест. Виждайки в своя народ почти съвършената популация за генетично проучване, той създава проект за свързване на родословната и медицинската документация с цел да се създаде база данни за търсене на гени. Въпреки достойната цел на проекта, местните закони за поверителността на информацията застават на пътя, докато парламентът на Исландия, основан през 930 година, през 1998 година приема закон за базата данни в здравния сектор. Законът оторизира „създаването и оперирането на централна база данни със здравна информация, без да се споменават конкретни имена, с цел увеличаване знанията, за да се подобрят здравето и здравното обслужване“.
През 2000 година deCODE Genetics получава дванайсетгодишен лиценз за изграждане и управляване на Исландската здравна база данни за собствена сметка, в замяна на ежегодната такса, плащана на правителството. Генеалогичният компонент на тази база данни съдържа информация в обществения сектор, но достъпът до медицинската информация е по-ограничен и се получава въз основа на „предполагаемо съгласие“ — информацията за здравето на хората се вкарва в база данни, ако те не поемат инициативата да изискат противното. Генотипният компонент е значително по-ограничен и разчита на заявеното съгласие — хората трябва да се съгласят активно да дадат тъканни проби за извличане на ДНК. Тук именно възникват споровете: deCODE Genetics разполага със система за защита на тайната на донора, но според критиците тя е несъвършена. Тъй като ДНК на дадения човек трябва да се свърже с родословната и медицинската документация, пробите не се вземат анонимно; затова пък самоличността на източника се кодира. На теория всеки код може да се разкодира. И може да се разчуе, особено възможно при такова малобройно население, че дадено семейство носи „лоши“ гени и така да се създадат възможности за генна дискриминация. Проектът на deCODE Genetics кристализира в най-големи детайли много от проблемите, свързани с генетичната тайна и досега дискутирани значително по-хипотетично. Въпреки споровете, повечето исландци са на страната на компанията, виждайки в това начин да се съчетае благородната мисия — борбата с вродените заболявания — с щастливата перспектива значителните парични постъпления да влеят „млада кръв“ в икономиката на страната. Във вълнението си много исландци инвестират значителни суми в компанията и разграбват акциите й на стойност 65 $, много преди deCODE Genetics да бъде пусната официално от NASDAQ. Но икономическият упадък не се церемони с биотехнологиите по принцип и с deCODE Genetics в частност. Не след дълго акциите струват около 2 $. На много исландци не им остава друго, освен да се разкайват за разгорещеното купуване на акции. Но въпреки всичко deCODE Genetics несъмнено вкарва пари в Исландия чрез плодотворното си сътрудничество с „Хофман-Ларош“ и Merck. Но готовността на Исландия да даде заем-гаранция от 200 000 000 $ и фактът, че deCODE Genetics е принудена да съкрати значителна част от работната си сила може би говорят нещо съвсем друго: не е изключено да се окаже, че deCODE Genetics всъщност съвсем не е чак толкова голям икономически бум за страната, както се е надявала.
Действителният тест за deCODE Genetics обаче не са приумиците на фондовата борса, а научният потенциал. За жалост комерсиалният императив информацията да не се разкрива или да се разкрива със закъснение затруднява преценката. Както научаваме от публикациите в пресата, компанията в момента осъществява анализ на свързването за четирийсет и шест болести, в това число астма, депресия, рак, остеопороза и високо кръвно налягане. Открити са свързващи маркери за двайсет и три от тях и са изолирани гени, допринасящи за заболяването на периферните кръвоносни съдове, инсулта и шизофренията. Но тъй като малко подробности се публикуват в научните списания, много често е трудно да се отличи науката от преувеличената реклама. Въпреки всичко deCODE доказва способността си да даде своя ценен принос: през юни 2002 година изследователите на deCODE публикуват нова карта на човешкия геном със значително по-висока резолюция от старата карта на Центъра за изучаване на полиморфизма при човека. Освен това, дългоочакваната публикация на изследванията на компанията на шизофренията й предсказва продуктивно научно — и комерсиално — бъдеще.
Независимо какво ще поднесат идните години на deCODE, очевидно общият й подход, обединяващ усилията на медицината, генеалогията и генетиката за по-пълно дефиниране на популацията, има голям потенциал. Това не е единствената компания, подлагаща популацията на цяла страна на обстойно генетично проучване. Населението на Финландия например, е 6 000 000 и 35 генетични заболявания се открояват като особено разпространени сред него, някои уникални, други просто се срещат по-често там, отколкото в другите европейски страни. Затова е естествено по-изостреното внимание на генетиците към финландците. Други държави също се устремяват да създават генетични бази данни. През април 2002 година във Великобритания стартира програмата „Биобанка“, правителството на Естония поддържа започналите подобни усилия в национален мащаб. Мащабни изследвания като тези на населението в крайна сметка ще ни помогнат да уловим и изплъзвалите ни се досега гени.
Човешката генетика има дълга история, започнала с любопитството на нашите предци за начина, по който определени характеристики се предават от поколение на поколение. Но буквално през цялата история, научната основа на подобни търсения е, меко казано, слаба. Опитите на Чарлз Дейвънпорт да подкрепи своята евгенична програма, като открие генетичната основа на тъй нареченото от него „слабоумие“, в редки случаи могат да бъдат окачествени като научни. Можем да получим представа колко бавно се развива тази област, като си припомним колко дълго приетата цифра за основен генетичен параметър, определящ нашия вид, беше грешна. Едва през 1956 година, три години след откриването на двойната спирала, броят на човешките хромозоми бе определен правилно като 46, а не 48, както се приемаше от 1935 година. Но приливът на информация, рукнал през двайсетте години, когато започна свързването на ограничаващия дължината на фрагментите полиморфизъм, с фантастична бързина превърна някога безплодната земя в плодородна градина. След като завършихме секвенционирането на човешкия геном, най-вероятно скоро ще открием всички гени, лежащи в основата на важните генетични болести. И в такъв случай се налага въпросът: „А какво ще правим с тях?“



